Prandina pentru tratamentul diabetului
Nume de marcă: Prandin
Denumire generică: repaglinidă
Cuprins:
Descriere
Farmacologie
Indicații și utilizare
Contraindicații
Măsuri de precauție
Reactii adverse
Supradozaj
Dozare
furnizat
Prandin, informații despre pacient (în engleză simplă)
Descriere
Prandin® (repaglinida) este un medicament care reduce nivelul glucozei din sânge din clasa meglitinidă gestionarea diabetului zaharat tip 2 (cunoscut și sub denumirea de diabet zaharat sau non-insulino-dependent) NIDDM). Repaglinida, acidul S (+) 2-etoxi-4 (2 ((3-metil-1- (2- (1-piperidinil) fenil)) -butil) amino) -2-oxoetil) benzoic, nu are legătură chimică cu administrarea orală secreton instrucțiuni de insulină sulfoniluree.
Formula structurală este cea prezentată mai jos:
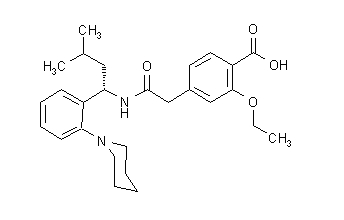
Repaglinida este o pulbere albă până alb-albă cu formula moleculară C27 H36 N2 O4 și o greutate moleculară de 452,6. Tabletele cu prandină conțin repaglinidă 0,5 mg, 1 mg sau 2 mg. În plus, fiecare comprimat conține următoarele ingrediente inactive: fosfat de calciu hidrogen (anhidru), celuloză microcristalină, amidon de porumb, potasiu polacrilin, povidonă, glicerol (85%), stearat de magneziu, meglumină, și poloxamer. Comprimatele de 1 mg și 2 mg conțin oxizi de fier (galben și, respectiv, roșu) ca agenți de colorare.
top
Farmacologie clinică
Mecanism de acțiune
Repaglinida scade nivelul glicemiei prin stimularea eliberării insulinei din pancreas. Această acțiune depinde de celulele beta (Ã beta) care funcționează în insulele pancreatice. Eliberarea insulinei este dependentă de glucoză și scade la concentrații scăzute de glucoză.
Repaglinida închide canalele de potasiu dependente de ATP în membrana celulară prin legare la locurile caracterizabile. Acest blocaj al canalului de potasiu depolarizează celula Ÿ, ceea ce duce la deschiderea canalelor de calciu. Fluxul crescut de calciu induce secreția de insulină. Mecanismul canalului ionic este foarte selectiv pentru țesut, cu afinitate scăzută pentru inima și mușchiul scheletului.
Farmacocinetica
Absorbţie:
După administrarea orală, repaglinida este absorbită rapid și complet din tractul gastro-intestinal. După doze orale unice și multiple la subiecți sănătoși sau la pacienți, nivelurile maxime de medicamente plasmatice (Cmax) apar în interval de o oră (Tmax). Repaglinida este eliminată rapid din fluxul de sânge cu un timp de înjumătățire de aproximativ 1 oră. Media biodisponibilității absolute este de 56%. Când repaglinida a fost administrată cu alimente, Tmax mediu nu a fost modificat, dar media Cmax și ASC (zona sub curba de concentrație plasmatică / timp) au fost reduse cu 20% și respectiv cu 12,4%.
Distribuție:
După administrarea intravenoasă (IV) la subiecți sănătoși, volumul de distribuție în stare de echilibru (Vss) a fost de 31 L, iar clearance-ul total al corpului (CL) a fost de 38 L / h. Legarea de proteine și legarea la albumina serică umană a fost mai mare de 98%.
Metabolism:
Repaglinida este metabolizată complet prin biotransformarea oxidativă și conjugarea directă cu acid glucuronic după o doză IV sau orală. Metaboliții principali sunt acidul dicarboxilic oxidat (M2), amina aromatică (M1) și acil glucuronida (M7). S-a dovedit că sistemul enzimatic citocrom P-450, în special 2C8 și 3A4, sunt implicați în N-dealkilarea repaglinidei la M2 și la oxidarea ulterioară la M1. Metaboliții nu contribuie la efectul de reducere a glucozei al repaglinidei.
Excreţie:
În decurs de 96 de ore după administrarea cu 14C-repaglinidă ca o singură doză orală, aproximativ 90% din radiomarcă a fost recuperată în materiile fecale și aproximativ 8% în urină. Doar 0,1% din doză este eliminată în urină sub formă de compus parental. Principalul metabolit (M2) a reprezentat 60% din doza administrată. Mai puțin de 2% din medicamentul părinte a fost recuperat în materiile fecale.
Parametri farmacocinetici:
Parametrii farmacocinetici ai repaglinidei obținuți dintr-un studiu croșetat cu o singură doză la subiecți sănătoși și de la un Studiul cu doze multiple, paralele, proporționalitate cu doza (0,5, 1, 2 și 4 mg) la pacienții cu diabet zaharat tip 2 sunt rezumate în următorul tabel:
| Parametru | Pacienții cu diabet de tip 2 * |
|
Doza 0,5 mg 1 mg 2 mg 4 mg |
ASC0-24 ore Media ± SD (ng / mL * oră): 68.9 ± 154.4 125.8 ± 129.8 152.4 ± 89.6 447.4 ± 211.3 |
|
Doza 0,5 mg 1 mg 2 mg 4 mg |
Cmax0-5 oră Media ± SD (ng / ml): 9.8 ± 10.2 18.3 ± 9.1 26.0 ± 13.0 65.8 ± 30.1 |
|
Doza 0,5 - 4 mg |
Tmax0-5 oră Mijloace (SD) 1,0 - 1,4 (0,3 - 0,5) oră |
|
Doza 0,5 - 4 mg |
T ½ Mijloace (Interval Ind) 1.0 - 1.4 (0.4 - 8.0) oră |
| Parametru | Subiecții sănătoși |
| CL bazat pe i.v. | 38 ± 16 L / oră |
| Vss bazat pe i.v. | 31 ± 12 L |
| AbsBio | 56 ± 9% |
|
CL = clearance-ul total al corpului Vss= volumul de distribuție în stare de echilibru AbsBio = biodisponibilitate absolută |
* dozat în prealabil cu trei mese
Aceste date indică faptul că repaglinida nu s-a acumulat în ser. Clearance-ul repaglinidului oral nu s-a modificat în intervalul de doze de 0,5 - 4 mg, ceea ce indică o relație liniară între doza și concentrațiile plasmatice ale medicamentului.
Variabilitatea expunerii:
Repaglinida ASC după doze multiple de 0,25 până la 4 mg cu fiecare masă variază pe o gamă largă. Coeficienții de variație intraindividuală și interindividuală au fost de 36%, respectiv 69%. ASC în intervalul dozei terapeutice a cuprins 69 până la 1005 ng / mL * oră, dar expunerea la ASC până la 5417 ng / mL * hr a fost atinsă în studiile de escaladare a dozei, fără consecințe adverse aparente.
Populații speciale:
geriatrie:
Voluntarii sănătoși au fost tratați cu un regim de 2 mg, luați înainte de fiecare din cele 3 mese. Nu au existat diferențe semnificative în farmacocinetica repaglinidă între grupul de pacienți PRECAUȚII, Utilizare geriatrică)
pediatric:
Nu au fost efectuate studii la pacienții pediatri.
Sex:
O comparație a farmacocineticii la bărbați și femei a arătat ASC peste doza de 0,5 mg până la 4 mg a fost mai mare cu 15% până la 70% la femeile cu diabet zaharat tip 2. Această diferență nu s-a reflectat în frecvența episoadelor hipoglicemice (bărbați: 16%; femeie: 17%) sau alte evenimente adverse. În ceea ce privește sexul, nu este indicată nicio modificare a recomandării generale a dozei, deoarece doza pentru fiecare pacient trebuie individualizată pentru a obține un răspuns clinic optim.
Cursă:
Nu au fost efectuate studii farmacocinetice care să evalueze efectele rasei, dar într-un studiu efectuat în SUA de un an la pacienții cu diabet de tip 2, efectul de scădere a glicemiei a fost comparabil între caucazieni (n = 297) și afro-americani (n = 33). Într-un studiu privind răspunsul la doză din SUA, nu a existat nicio diferență aparentă de expunere (ASC) între caucazieni (n = 74) și hispanici (n = 33).
Interacțiunile medicamentoase
Studiile de interacțiune medicamentoasă efectuate la voluntari sănătoși arată că Prandin nu a avut niciun efect relevant clinic asupra proprietăților farmacocinetice ale digoxinei, teofilinei sau warfarinei. Administrarea concomitentă de cimetidină cu Prandin nu a modificat în mod semnificativ absorbția și dispunerea repaglinidei.
În plus, următoarele medicamente au fost studiate la voluntari sănătoși cu administrarea concomitentă de Prandin. Mai jos sunt prezentate rezultatele:
Gemfibrozil și Itraconazol:
Administrarea concomitentă de gemfibrozil (600 mg) și o doză unică de 0,25 mg Prandin (după 3 zile de 600 de două ori pe zi gemfibrozil) a avut ca rezultat un ASC de repaglinidă de 8,1 ori mai mare și timpul de înjumătățire a repaglinidei prelungit de la 1,3 la 3,7 ore. Administrarea concomitentă cu itraconazol și o doză unică de 0,25 mg Prandin (în a treia zi a un regim de 200 mg doză inițială, de două ori pe zi itraconazol de 100 mg) a dus la o creștere de 1,4 ori mai mare AUC repaglinidă. Administrarea concomitentă atât de gemfibrozil cât și de itraconazol cu Prandin a dus la o ASC a repaglinidei de 19 ori mai mare și la timpul de înjumătățire a repaglinidei prelungite până la 6,1 ore. Concentrația de repaglinidă plasmatică la 7 ore a crescut de 28,6 ori cu administrarea concomitentă de gemfibrozil și de 70,4 ori cu combinația de gemfibrozil-itraconazol (vezi PRECAUȚII, Interacțiuni medicamente-droguri).
Ketoconazol:
Administrarea concomitentă de 200 mg ketoconazol și o doză unică de 2 mg Prandin (după 4 zile o dată) ketoconazol zilnic 200 mg) a condus la o creștere a ASC și a Cmax a repaglinidei cu 15% și 16%, respectiv. Creșterile au fost de la 20,2 ng / mL la 23,5 ng / mL pentru Cmax și de la 38,9 ng / mL * hr la 44,9 ng / mL * hr pentru ASC.
Rifampicina:
Administrarea concomitentă de 600 mg rifampină și o doză unică de 4 mg Prandin (după 6 zile de o dată pe zi rifampină 600 mg) a dus la o scădere de 32% și, respectiv, 26% a ASC și a Cmax de repaglinidă. Scăderile au fost de la 40,4 ng / mL la 29,7 ng / mL pentru Cmax și de la 56,8 ng / mL * hr la 38,7 ng / mL * hr pentru ASC.
Într-un alt studiu, administrarea concomitentă de 600 mg rifampină și o doză unică de 4 mg Prandin (după 6 zile o dată rifampin zilnic 600 mg) a dus la o scădere cu 48% și 17% a ASC medică repaglinidă și Cmax mediană respectiv. Scăderile mediane au fost de la 54 ng / mL * hr la 28 ng / mL * hr pentru ASC și de la 35 ng / mL la 29 ng / ml pentru Cmax. Prandina administrată singură (după 7 zile de o dată pe zi rifampină 600 mg) a dus la o scădere de 80% și 79% a ASC median și respectiv a Cmax cu repaglinidă. Scăderile au fost de la 54 ng / mL * hr la 11 ng / mL * hr pentru ASC și de la 35 ng / mL la 7,5 ng / mL pentru Cmax.
Levonorgestrel și Etinil Estradiol:
Administrarea concomitentă a unei tablete combinate de 0,15 mg levonorgestrel și 0,03 mg etinilestradiol administrate o dată pe zi timp de 21 de zile cu 2 mg Prandin administrată de trei ori pe zi (zilele 1-4) și o singură doză în ziua a 5-a a dus la creșterea cu 20% a repaglinidei, a levonorgestrelului și a etinilestradiolului Cmax. Creșterea Cmax de repaglinidă a fost de la 40,5 ng / ml la 47,4 ng / ml. Parametrii ASC ai etinilestradiolului au crescut cu 20%, în timp ce valorile ASC ale repaglinidei și levonorgestrelului au rămas neschimbate.
Simvastatin:
Administrarea concomitentă de 20 mg simvastatină și o doză unică de 2 mg Prandin (după 4 zile de o dată pe zi simvastatină 20 mg și de trei ori pe zi Prandin 2 mg) au dus la o creștere cu 26% a Cmax repaglinidă de la 23,6 ng / ml la 29,7 ng / ml. ASC a fost neschimbat.
nifedipina:
Administrarea concomitentă de 10 mg nifedipină cu o singură doză de 2 mg Prandin (după 4 zile de trei ori pe zi nifedipină 10 mg și de trei ori pe zi Prandin 2 mg) au dus la valori neschimbate ale ASC și Cmax pentru ambele droguri.
Claritromicină:
Administrarea concomitentă de 250 mg claritromicină și o doză unică de 0,25 mg Prandin (după 4 zile de două ori claritromicina zilnică de 250 mg) a dus la o creștere de 40% și 67% a ASC și Cmax a repaglinidei, respectiv. Creșterea ASC a fost de la 5,3 ng / mL * hr la 7,5 ng / mL * hr și creșterea Cmax a fost de la 4,4 ng / mL la 7,3 ng / mL.
trimetoprim:
Administrarea concomitentă de 160 mg trimetoprim și o doză unică de 0,25 mg Prandin (după 2 zile de două ori pe zi și una doza în a treia zi de trimetoprim 160 mg) a dus la o creștere de 61% și 41% a ASC și Cmax de repaglinidă, respectiv. Creșterea ASC a fost de la 5,9 ng / mL * hr la 9,6 ng / mL * hr și creșterea Cmax a fost de la 4,7 ng / mL la 6,6 ng / mL.
Insuficiență renală
Farmacocinetica în doză unică și în stare constantă a repaglinidei au fost comparate între pacienții cu diabet zaharat tip 2 și funcția renală normală (CrCl> 80 ml / min), insuficiență a funcției renale ușoare până la moderate (CrCl = 40 - 80 mL / min) și afectare severă a funcției renale (CrCl = 20 - 40 ml / min). Atât ASC, cât și Cmax de repaglinidă au fost similare la pacienții cu funcție renală normală și ușoară până la moderată (valori medii 56,7 ng / mL * hr față de 57,2 ng / mL * hr și 37,5 ng / mL vs 37,7 ng / mL.) Pacienții cu funcție renală severă redusă au avut ASC și Cmax medii ridicate valori (98,0 ng / mL * hr și respectiv 50,7 ng / mL), dar acest studiu a arătat doar o corelație slabă între nivelurile de repaglinidă și creatinină clearance-ul. Reglarea inițială a dozei nu pare a fi necesară pentru pacienții cu disfuncție renală ușoară până la moderată. Cu toate acestea, pacienții cu diabet zaharat de tip 2, care au o insuficiență renală severă a funcției renale, trebuie să inițieze terapia cu Prandin cu doza de 0,5 mg - ulterior, pacienții trebuie titrați cu atenție. Nu s-au efectuat studii la pacienți cu clearance-uri ale creatininei sub 20 ml / min sau la pacienții cu insuficiență renală care necesită hemodializă.
Insuficiență hepatică
Un studiu cu doză unică, deschisă, a fost efectuat la 12 subiecți sănătoși și 12 pacienți cu boală hepatică cronică (CLD), clasificat după scala Child-Pugh și clearance-ul cafeinei. Pacienții cu insuficiență moderată până la severă a funcției hepatice au avut concentrații serice mai mari și mai prelungite de repaglinidă totală și nelegată decât subiecții sănătoși (ASC: 91,6 ng / mL * hr; Pacienți AUCCLD: 368,9 ng / ml * hr; Cmax, sănătos: 46,7 ng / ml; Cmax, pacienți cu CLD: 105,4 ng / ml). ASC a fost corelat statistic cu clearance-ul cafeinei. Nu a fost observată nicio diferență în profilurile de glucoză la grupurile de pacienți. Pacienții cu funcție hepatică afectată pot fi expuși la concentrații mai mari de repaglinidă și metaboliții asociați decât pacienții cu funcție hepatică normală care primesc doze uzuale. Prin urmare, Prandin trebuie utilizat cu precauție la pacienții cu funcție hepatică afectată. Intervalele mai lungi între ajustările dozei trebuie utilizate pentru a permite evaluarea completă a răspunsului.
Studii clinice
Încercări de monoterapie
Un studiu de răspuns la doză de două săptămâni, dublu orb, controlat cu placebo a fost efectuat la 138 de pacienți cu diabet zaharat tip 2, utilizând doze cuprinse între 0,25 și 4 mg, luate cu fiecare din cele trei mese. Terapia cu prandină a dus la scăderea glucozei proporționale cu doza pe întreaga gamă a dozei. Nivelurile de insulină plasmatică au crescut după mese și au revenit la nivelul de bază înainte de următoarea masă. Cea mai mare parte a efectului de reducere a glucozei din sânge a fost demonstrată în 1-2 săptămâni.
Într-un studiu de titrare a dozei de două luni, dublu orb, controlat cu placebo, Prandin sau doze placebo pentru fiecare pacient au fost a crescut săptămânal de la 0,25 mg până la 0,5, 1 și 2 mg, până la maximum 4 mg, până la glucoza plasmatică în condiții de post (FPG) nivel
Prandin vs. Tratamentul cu placebo: FPG mediu, PPG și HbA1c Modificări de la nivelul inițial după 3 luni de tratament:
| ||||||
| FPG (mg / dL) | PPG (mg / dL) | HbA1c (%) | ||||
| PL | R | PL | R | PL | R | |
| De bază | 215.3 | 220.2 | 245.2 | 261.7 | 8.1 | 8.5 |
|
Schimbare de la linia de bază (la ultima vizită) |
30.3 | -31.0* | 56.5 | -47.6* |
1.1 | -0.6* |
|
FPG = glucoză plasmatică în condiții de repaus PPG = glucoză post-prandială PL = placebo (N = 33) R = repaglinidă (N = 66) |
Un alt dublu-orb, controlat cu placebo a fost efectuat la 362 de pacienți tratați timp de 24 de săptămâni. Eficacitatea dozelor preprandiale de 1 și 4 mg a fost demonstrată prin scăderea glucozei din sânge în condiții de repaus și prin HbA1c la sfârșitul studiului. HbA1c pentru grupele tratate cu Prandin (grupuri de 1 și 4 mg combinate) la sfârșitul studiului a fost redus comparativ cu tratamentul placebo grup la pacienții naivi anterior și la pacienții tratați anterior cu agenți hipoglicemici orali cu 2,1% unități și 1,7% unități, respectiv. În acest studiu cu doză fixă, pacienții care au fost naivi la terapia cu agent hipoglicemic oral și pacienții în stare relativ bună controlul glicemic la nivelul inițial (HbA1c sub 8%) a arătat o scădere mai mare a glicemiei, inclusiv o frecvență mai mare de hipoglicemie. Pacienții care au fost tratați anterior și care au avut HbA1c inițial - 8% au raportat hipoglicemie în același ritm ca pacienții randomizați cu placebo. Nu a existat un câștig mediu în greutate corporală când pacienții tratați anterior cu agenți hipoglicemici orali au fost comutați la Prandin. Creșterea medie în greutate la pacienții tratați cu Prandin și care nu au fost tratați anterior cu medicamente sulfoniluree a fost de 3,3%.
Dozarea Prandin în raport cu eliberarea de insulină legată de masă a fost studiată în trei studii, inclusiv la 58 de pacienți. Controlul glicemic a fost menținut într-o perioadă în care masa și dozajul au fost variate (2, 3 sau 4 mese pe zi; înainte de mese x 2, 3 sau 4) comparativ cu o perioadă de 3 mese regulate și 3 doze pe zi (înainte de mese x 3). S-a arătat, de asemenea, că Prandin poate fi administrat la începutul unei mese, cu 15 minute înainte, sau cu 30 de minute înainte de masă, cu același efect de scădere a glicemiei.
Prandin a fost comparat cu alte secrete de insulină în studiile controlate de un an pentru a demonstra comparabilitatea eficacității și siguranței. Hipoglicemia a fost raportată la 16% din 1228 de pacienți cu prandină, 20% din 417 pacienți cu glicuridă și 19% din 81 de pacienți cu glipizidă. Dintre pacienții tratați cu prandină cu hipoglicemie simptomatică, niciunul nu a dezvoltat comă sau a necesitat spitalizare.
Studii combinate
Prandinul a fost studiat în combinație cu metformină la 83 de pacienți care nu au fost controlați în mod satisfăcător la antrenament, dietă și metformină numai. Doza de prandin a fost titrată timp de 4 până la 8 săptămâni, urmată de o perioadă de întreținere de 3 luni. Terapia combinată cu Prandin și metformin a dus la o îmbunătățire semnificativ mai mare a controlului glicemic în comparație cu repaglinida sau monoterapia cu metformină. HbA1c a fost îmbunătățit cu 1% unitate și FPG a scăzut cu 35 mg / dl suplimentar. În acest studiu, unde doza de metformină a fost menținută constantă, terapia combinată cu Prandin și metformină a arătat efecte de reducere a dozei în raport cu Prandin. Răspunsul mai mare al eficacității grupului combinat a fost obținut la o doză zilnică mai mică de repaglinidă decât la grupul de monoterapie Prandin (vezi tabelul).
Terapia cu prandină și metformină: modificări medii de la nivelul inițial al parametrilor glicemici și greutate după 4-5 luni de tratament *
| Prandin | Combinaţie | Metformina | |
| N | 28 | 27 | 27 |
|
Doza finală mediană (Mg / zi) |
12 |
6 (Prandin) 1500 (metformin) |
1500 |
| HbA1c (% unități) | -0.38 | -1.41** | -0.33 |
| FPG (mg / dL) | 8.8 | -39.2** | -4.5 |
| Greutate (kg) | 3.0 | 2.4*** | -0.90 |
* bazat pe analiza intenției de a trata
** p <0,05, pentru comparații în perechi cu Prandin și metformină.
*** p <0,05, pentru compararea în perechi cu metformină.
Un regim de terapie combinată de Prandin și pioglitazonă a fost comparat cu monoterapia cu oricare dintre agenții singuri în a Studiu de 24 de săptămâni care a înscris 246 pacienți tratați anterior cu monoterapie cu sulfoniluree sau metformină (HbA1c> 7.0%). Numărul de pacienți tratați au fost: Prandin (N = 61), pioglitazonă (N = 62), combinație (N = 123). Doza de prandin a fost titrată în primele 12 săptămâni, urmată de o perioadă de întreținere de 12 săptămâni. Terapia combinată a dus la o îmbunătățire semnificativ mai mare a controlului glicemic în comparație cu monoterapia (figura de mai jos). Modificările de la nivelul inițial pentru completatori în FPG (mg / dL) și HbA1c (%), respectiv au fost: -39,8 și -0,1 pentru Prandin, -35,3 și -0,1 pentru pioglitazonă și -92,4 și -1,9 pentru combinație. În acest studiu în care doza de pioglitazonă a fost menținută constantă, grupul de terapie combinată a arătat efecte de reducere a dozei în ceea ce privește Prandin (vezi figura legendă). Răspunsul mai mare al eficacității grupului combinat a fost obținut la o doză zilnică mai mică de repaglinidă decât în grupul de monoterapie Prandin. Creșterile medii în greutate asociate cu combinația, terapia cu Prandin și pioglitazonă au fost de 5,5 kg, 0,3 kg, respectiv 2,0 kg.
HbA1c Valorile studiului de combinație Prandin / Pioglitazonă
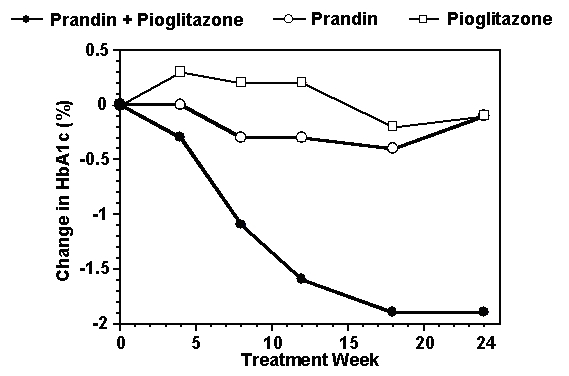
HbA1c valori pe săptămâna de studiu pentru pacienții care au terminat studiul (combinație, N = 101; Prandin, N = 35, pioglitazonă, N = 26).
Subiecții cu FPG peste 270 mg / dL au fost retrași din studiu.
Doza de pioglitazonă: fixată la 30 mg / zi; Doza finală mediană Prandin: 6 mg / zi pentru asociere și 10 mg / zi pentru monoterapie.
Un regim terapeutic combinat de Prandin și rosiglitazonă a fost comparat cu monoterapia cu oricare dintre agenți singur într-un studiu de 24 de săptămâni care a înscris 252 de pacienți tratați anterior cu sulfonilurea sau metformină (HbA1c > 7.0%). Terapia combinată a dus la o îmbunătățire semnificativă a controlului glicemic în comparație cu monoterapia (tabelul de mai jos). Efectele glicemice ale terapiei combinate au reprezentat o reducere a dozei, atât la doza zilnică totală de Prandin, cât și la doza zilnică totală de rosiglitazonă (vezi legenda tabelului). Un răspuns mai mare al eficacității grupului de terapie combinată a fost obținut cu jumătate din doza zilnică medie de Prandin și rosiglitazonă, comparativ cu grupurile de monoterapie respective. Modificarea medie în greutate asociată cu terapia combinată a fost mai mare decât cea a monoterapiei cu Prandin.
Modificări medii de la valoarea inițială a parametrilor glicemici și a greutății într-un studiu combinat pe 24 de săptămâni / rosiglitazonă *
| Prandin | Combinaţie | Rosiglitazonă | |
| N | 63 | 127 | 62 |
| HbA1c (%) | |||
| De bază | 9.3 | 9.1 | 9.0 |
| Schimbare cu 24 de săptămâni | -0.17 | -1.43** | -0.56 |
| FPG (mg / dL) | |||
| De bază | 269 | 257 | 252 |
| Schimbare cu 24 de săptămâni | -54 | -94** | -67 |
| Schimbare în greutate (kg) | +1.3 | +4.5*** | +3.3 |
Doze mediane finale: rosiglitazonă - 4 mg / zi pentru asociere și 8 mg / zi pentru monoterapie; Prandin - 6 mg / zi pentru asociere și 12 mg / zi pentru monoterapie |
* bazat pe analiza intenției de a trata
** p-valoare ‰ ¤ 0,001 pentru comparație fie cu monoterapie
*** valoarea p <0,001 pentru comparație cu Prandin
top
Indicații și utilizare
Prandina este indicată ca adjuvant la dietă și exerciții fizice pentru a îmbunătăți controlul glicemic la adulții cu diabet zaharat de tip 2.
top
Contraindicații
Prandin este contraindicat la pacienții cu:
- Cetoacidoză diabetică, cu sau fără comă. Această afecțiune trebuie tratată cu insulină.
- Diabetul de tip 1.
- Hipersensibilitate cunoscută la medicament sau la ingredientele sale inactive.
top
Măsuri de precauție
General:
Prandina nu este indicată pentru utilizare în combinație cu NPH-insulină (Vezi REACTII ADVERSE, Evenimente cardiovasculare)
Rezultate macrovasculare:
Nu au existat studii clinice care să stabilească dovezi concludente privind reducerea riscului macrovascular cu Prandin sau orice alt medicament anti-diabetic.
hipoglicemia:
Toate medicamentele orale de reducere a glicemiei, inclusiv repaglinida, sunt capabile să producă hipoglicemie. Selectarea corectă a pacientului, dozarea și instrucțiunile pentru pacienți sunt importante pentru a evita episoadele hipoglicemice. Insuficiența hepatică poate provoca niveluri crescute de repaglinidă din sânge și poate diminua capacitatea gluconeogenă, ambele cresc riscul de hipoglicemie gravă. Pacienți vârstnici, debilitați sau subnutriți și cei cu suprarenale, hipofize, hepatice sau severe insuficiența renală poate fi în special sensibilă la acțiunea hipoglicemică de scădere a glucozei droguri.
Hipoglicemia poate fi dificil de recunoscut la vârstnici și la persoanele care iau medicamente blocante beta-adrenergice. Hipoglicemia este mai probabilă să apară atunci când aportul caloric este deficitar, după exerciții fizice severe sau prelungite, când este ingerat alcool sau atunci când se utilizează mai mult de un medicament care scade glucoza.
Frecvența hipoglicemiei este mai mare la pacienții cu diabet zaharat de tip 2 care nu au fost tratați anterior cu medicamente pentru reducerea glicemiei orale (nave) sau al căror HbA1c este mai mic de 8%. Prandinul trebuie administrat cu mese pentru a reduce riscul de hipoglicemie.
Pierderea controlului glucozei din sânge:
Când un pacient stabilizat la orice regim diabetic este expus la stres, cum ar fi febră, traume, infecții sau intervenții chirurgicale, poate apărea o pierdere a controlului glicemic. În astfel de momente, poate fi necesară întreruperea Prandinului și administrarea insulinei. Eficiența oricărui medicament hipoglicemic în scăderea glicemiei la un nivel dorit scade la mulți pacienți o perioadă de timp, care se poate datora progresiei gravității diabetului sau a unei reacții reduse la medicament. Acest fenomen este cunoscut sub numele de eșec secundar, pentru a-l distinge de eșecul primar în care medicamentul este ineficient la un pacient individual atunci când este administrat pentru prima dată. Reglarea adecvată a dozei și respectarea dietei trebuie evaluată înainte de a clasifica un pacient ca un eșec secundar.
Informații pentru pacienți
Pacienții trebuie informați despre riscurile și avantajele potențiale ale Prandin și despre modurile alternative de terapie. De asemenea, aceștia trebuie informați despre importanța respectării instrucțiunilor dietetice, a unui program de exerciții fizice regulate și a testării periodice a glicemiei și a HbA1c. Riscurile hipoglicemiei, simptomele și tratamentul acesteia și condițiile care predispun la dezvoltarea acesteia și administrarea concomitentă a altor medicamente care reduc glucoza trebuie explicată pacienților și familiei responsabile membri. De asemenea, ar trebui explicată eșecul primar și secundar.
Pacienții trebuie instruiți să ia Prandin înainte de masă (2, 3 sau de 4 ori pe zi, în mod prealabil). Dozele sunt luate de obicei în termen de 15 minute de la masă, dar timpul poate varia de la înaintea mesei până la 30 de minute înainte de masă. Pacienților care sar peste o masă (sau adaugă o masă suplimentară) trebuie să li se solicite să sară (sau să adauge) o doză pentru acea masă.
Teste de laborator
Răspunsul la toate terapiile diabetice trebuie monitorizat prin măsurători periodice ale sângelui în post niveluri de glucoză și hemoglobină glicozilată cu scopul de a reduce aceste niveluri spre normal gamă. În timpul ajustării dozei, glucoza în condiții de repaus poate fi utilizată pentru a determina răspunsul terapeutic. După aceea, atât glucoza cât și hemoglobina glicozilată trebuie monitorizate. Hemoglobina glicozilată poate fi utilă în special pentru evaluarea controlului glicemic pe termen lung. Testele postprandiale ale nivelului de glucoză pot fi utile clinic la pacienții ale căror niveluri de glucoză din sânge înainte de masă sunt satisfăcătoare, dar al căror control global al glicemiei (HbA1c) este inadecvat.
Interacțiunile medicament-drog
Datele in vitro indică faptul că Prandina este metabolizată de enzimele citocromului P450 2C8 și 3A4. În consecință, metabolismul repaglinidului poate fi modificat de medicamente care influențează aceste sisteme de enzime citocrom P450 prin inducție și inhibare. Prin urmare, trebuie să se utilizeze precauție la pacienții aflați pe Prandin și care iau inhibitori și / sau inductori ai CYP2C8 și CYP3A4. Efectul poate fi foarte semnificativ dacă ambele enzime sunt inhibate în același timp, ducând la o creștere substanțială a concentrațiilor plasmatice de repaglinidă. Medicamentele despre care se știe că inhibă CYP3A4 includ agenți antifungici precum ketoconazolul, itraconazolul și agenți antibacterieni precum eritromicina. Medicamentele despre care se știe că inhibă CYP2C8 includ agenți precum trimetoprim, gemfibrozil și montelukast. Medicamentele care induc sistemele enzimelor CYP3A4 și / sau 2C8 includ rifampina, barbituricele și carbamezapina. Vedea FARMACOLOGIE CLINICĂ secțiunea, Interacțiuni medicamente-droguri.
Date in vivo dintr-un studiu care a evaluat co-administrarea unei enzime 3A4 a citocromului P450 inhibitorul, claritromicina, cu Prandin a dus la o creștere semnificativă clinic a repaglinidei nivelurile plasmatice. În plus, a fost observată o creștere a nivelului plasmatic al repaglinidei într-un studiu care a evaluat co-administrarea de Prandin cu trimetoprim, un inhibitor al enzimei 2C8 a citocromului P-450. Aceste creșteri ale nivelului plasmatic de repaglinidă pot necesita o ajustare a dozei de Prandin. Vedea FARMACOLOGIE CLINICĂsecțiunea, Interacțiuni medicamente-droguri.
Datele in vivo ale unui studiu care a evaluat administrarea concomitentă de gemfibrozil cu Prandin la subiecți sănătoși au condus la o creștere semnificativă a nivelului de sânge de repaglinidă. Pacienții care iau Prandin nu trebuie să înceapă să ia gemfibrozil; pacienții care iau gemfibrozil nu trebuie să înceapă să ia Prandin. Utilizarea concomitentă poate duce la efecte mai mari și prelungite ale reducerii glicemiei în repaglinidă. Trebuie să se utilizeze prudență la pacienții deja aflați pe Prandin și gemfibrozil - trebuie monitorizate nivelurile de glucoză din sânge și poate fi necesară ajustarea dozei de Prandin. La pacienții care au luat Prandin și gemfibrozil împreună au fost raportate evenimente rare de comercializare post-hipoglicemie gravă. Gemfibrozil și itraconazol au avut un efect inhibitor metabolic sinergic asupra Prandinului. Prin urmare, pacienții care iau Prandin și gemfibrozil nu trebuie să ia itraconazol. Vedea FARMACOLOGIE CLINICĂ secțiunea, Interacțiuni medicamente-droguri.
Acțiunea hipoglicemică a agenților de scădere a glicemiei orale poate fi potențată de anumite medicamente, inclusiv agenți antiinflamatori nesteroizi și alte medicamente care sunt puternic legate de proteine, salicilați, sulfonamide, cloramfenicol, cummarine, inhibitori de probenecid, monoaminoxidază și blocare beta-adrenergică agenți. Când astfel de medicamente sunt administrate unui pacient care primește agenți de reducere a glicemiei orale, pacientul trebuie observat îndeaproape pentru hipoglicemie. Atunci când astfel de medicamente sunt retrase de la un pacient care primește agenți de reducere a glucozei din sânge, pacientul trebuie observat îndeaproape pentru pierderea controlului glicemic.
Anumite medicamente tind să producă hiperglicemie și pot duce la pierderea controlului glicemic. Aceste medicamente includ tiazidele și alte diuretice, corticosteroizi, fenotiazine, produse tiroidiene, estrogeni, contraceptive orale, fenitoină, acid nicotinic, simpatomimetice, medicamente care blochează canalul de calciu și izoniazida. Când aceste medicamente sunt administrate unui pacient care primește agenți de reducere a glicemiei pe cale orală, pacientul trebuie observat pentru pierderea controlului glicemic. Când aceste medicamente sunt retrase de la un pacient care primește agenți de reducere a glucozei din sânge, pacientul trebuie să fie observat îndeaproape pentru hipoglicemie.
Carcinogeneza, mutageneza și afectarea fertilității
Studii de carcinogenitate pe termen lung au fost efectuate timp de 104 săptămâni, în doze de până la 120 mg / kg greutate corporală / zi (șobolani) și 500 mg / kg greutate corporală / zi (șoareci) sau de aproximativ 60 și respectiv 125 de ori expunere clinică la un mg / m2 bază. Nu s-au găsit dovezi de carcinogenitate la șoareci sau șobolani. La șobolanii masculi, a existat o incidență crescută a adenoamelor benigne ale tiroidei și ficatului. Relevanța acestor descoperiri pentru oameni este neclară. Dozele fără efect pentru aceste observații la șobolani masculi au fost de 30 mg / kg greutate corporală / zi pentru tumorile tiroidiene și 60 mg / kg greutate corporală / zi pentru tumorile hepatice, care sunt de peste 15 și respectiv 30 de ori, expunere clinică la un mg / m2 bază.
Repaglinida a fost non-genotoxică într-o baterie de studii in vivo și in vitro: mutageneză bacteriană (test Ames), test de mutație a celulelor înainte in vitro în celulele V79 (HGPRT), test de aberație cromozomială in vitro în limfocitele umane, sinteza neprogramată și replicantă a ADN-ului în ficatul de șobolan și in vivo micronucleu de șoarece și șobolan teste.
Fertilitatea șobolanilor de sex masculin și feminin nu a fost afectată prin administrarea de repaglinide în doze de până la 80 mg / kg greutate corporală / zi (femei) și 300 mg / kg greutate corporală / zi (bărbați); de peste 40 de ori expunere clinică pe bază de mg / m2.
graviditate
Sarcina categoria C
Efecte teratogene
Nu a fost stabilită siguranța la gravide. Repaglinida nu a fost teratogenă la șobolani sau iepuri la doze de 40 de ori (șobolani) și de aproximativ 0,8 ori (expunere) clinică (pe bază de mg / m2) pe toată durata sarcinii. Deoarece studiile asupra reproducerii la animale nu sunt întotdeauna predictive pentru răspunsul uman, Prandin trebuie utilizat în timpul sarcinii numai dacă este clar necesar.
Deoarece informațiile recente sugerează că nivelurile anormale ale glicemiei în timpul sarcinii sunt asociate cu o incidență mai mare a anomalii congenitale, mulți experți recomandă utilizarea insulinei în timpul sarcinii pentru a menține nivelul glicemiei cât mai aproape de normal pe cat posibil.
Efecte netratogene
Procesul barajelor de șobolan expuse la repaglinidă de 15 ori expunerea clinică pe o bază de mg / m2 în zilele 17 - 22 de gestație și în timpul alăptarea a dezvoltat deformări ale scheletului netratratice constând în scurtarea, îngroșarea și îndoirea humerusului în perioada postnatală perioadă. Acest efect nu a fost observat la doze de până la 2,5 ori expunere clinică (pe bază de mg / m2) în zilele 1 până la 22 de sarcină sau la doze mai mari administrate în zilele 1 până la 16 de sarcină. Expunerea umană relevantă nu a apărut până în prezent și, prin urmare, nu poate fi stabilită siguranța administrării Prandin pe parcursul sarcinii sau alăptării.
Mamele care alăptează
În studiile de reproducere a șobolanului, au fost detectate niveluri măsurabile de repaglinidă în laptele matern al barajelor și s-au observat niveluri scăzute ale glicemiei la pui. Studiile încurajatoare încrucișate au indicat că pot fi induse modificări ale scheletului (a se vedea efectele netratratice de mai sus) controlați puii alăptați de barajele tratate, deși acest lucru s-a produs într-un grad mai mic decât acei pui tratați în utero. Deși nu se știe dacă repaglinida este excretată în laptele uman, unii agenți orali sunt cunoscuți ca fiind excretați pe această cale. Deoarece există potențial de hipoglicemie la sugarii care alăptează și, din cauza efectelor asupra animalelor care alăptează, a ar trebui să se ia decizia dacă Prandin trebuie întrerupt la mamele care alăptează sau dacă mamele trebuie să întrerupă asistență medicală. Dacă Prandin este întrerupt și dacă dieta este insuficientă pentru controlul glicemiei, trebuie luată în considerare terapia cu insulină.
Utilizare pediatrică
Nu au fost efectuate studii la pacienții pediatri.
Utilizare geriatrică
În studiile clinice cu repaglinidă cu o durată mai mare de 24 de săptămâni, 415 pacienți aveau peste 65 de ani. În studiile controlate activ de un an, nu au fost observate diferențe în ceea ce privește eficacitatea sau evenimentele adverse între acești subiecți și cei cu mai puțin de 65 de ani decât creșterea preconizată legată de vârstă a evenimentelor cardiovasculare observate pentru Prandin și comparator droguri. Nu a fost înregistrată o creștere a frecvenței sau a gravității hipoglicemiei la subiecții mai în vârstă. Alte experiențe clinice raportate nu au identificat diferențe în răspunsurile dintre vârstnici și pacienții mai tineri, dar nu poate fi exclusă o sensibilitate mai mare a unor persoane mai în vârstă la terapia cu Prandin out.
top
Reactii adverse
Hipoglicemie: vezi PRECAUȚII șiSupradozare secțiuni.
Prandin a fost administrat la 2931 de persoane în timpul studiilor clinice. Aproximativ 1500 dintre acești indivizi cu diabet de tip 2 au fost tratați cel puțin 3 luni, 1000 timp de cel puțin 6 luni și 800 timp de cel puțin 1 an. Majoritatea acestor indivizi (1228) au primit Prandin într-unul din cele cinci studii de 1 an, controlate activ. Medicamentele de comparație din aceste studii de un an au fost medicamente sulfoniluree orale (SU), inclusiv glicurură și glipizidă. Peste un an, 13% dintre pacienții cu Prandin au fost întreruși din cauza evenimentelor adverse, la fel și 14% dintre pacienții cu SU. Cele mai frecvente evenimente adverse care au dus la retragere au fost hiperglicemia, hipoglicemia și simptomele conexe (vezi PRECAUȚII). Hipoglicemie ușoară sau moderată a apărut la 16% dintre pacienții cu Prandin, 20% dintre pacienții cu glicuridă și 19% din pacienții cu glipizidă.
Tabelul de mai jos prezintă evenimentele adverse frecvente pentru pacienții cu Prandin în comparație atât cu placebo (în studiile cu durată de 12 până la 24 de săptămâni), cât și cu glicuridă și glipizidă în studiile de un an. Profilul de reacție adversă al Prandinului a fost, în general, comparabil cu cel al medicamentelor sulfoniluree (SU).
Evenimente adverse raportate în mod frecvent (% dintre pacienți) *
| EVENIMENT | Prandin |
PLACEBO | Prandin |
SU |
| N = 352 | N = 108 | N = 1228 | N = 498 | |
| Studii controlate cu placebo | Studii controlate active | |||
| Metabolic | ||||
| hipoglicemia | 31** | 7 | 16 | 20 |
| Respirator | ||||
| URI | 16 | 8 | 10 | 10 |
| sinuzita | 6 | 2 | 3 | 4 |
| rinita | 3 | 3 | 7 | 8 |
| Bronşită | 2 | 1 | 6 | 7 |
| Gastrointestinal | ||||
| Greaţă | 5 | 5 | 3 | 2 |
| Diaree | 5 | 2 | 4 | 6 |
| Constipație | 3 | 2 | 2 | 3 |
| Vărsături | 3 | 3 | 2 | 1 |
| Dispepsie | 2 | 2 | 4 | 2 |
| Tulburări musculo-scheletice | ||||
| artralgia | 6 | 3 | 3 | 4 |
| Dureri de spate | 5 | 4 | 6 | 7 |
| Alte | ||||
| Durere de cap | 11 | 10 | 9 | 8 |
| parestezii | 3 | 3 | 2 | 1 |
| Dureri în piept | 3 | 1 | 2 | 1 |
| Infecții ale tractului urinar | 2 | 1 | 3 | 3 |
| Tulburarea dinților | 2 | 0 | <1 | <1 |
| Alergie | 2 | 0 | 1 | <1 |
* Evenimente - 2 ¥ 2% pentru grupul Prandin din studiile controlate cu placebo și evenimente „din grupul placebo
** Vezi descrierea procesului în FARMACOLOGIE CLINICĂ, Studii clinice.
Evenimente cardiovasculare
În studiile de un an care compară Prandin cu medicamente cu sulfonilurea, incidența anginei a fost comparabilă (1,8%) pentru ambele tratamente, cu o incidență a durerii toracice de 1,8% pentru Prandin și 1,0% pentru sulfonilureice. Incidența altor evenimente cardiovasculare selectate (hipertensiune arterială, EKG anormal, miocard infarct, aritmii și palpitații) a fost ‰ ¤ 1% și nu a fost diferit între Prandin și medicamente comparative.
Incidența reacțiilor adverse cardiovasculare serioase totale, inclusiv ischemia, a fost mai mare pentru repaglinida (4%) decât pentru medicamentele cu sulfonilurea (3%) în studiile clinice comparative controlate. În studiile controlate de un an, tratamentul cu Prandin nu a fost asociat cu excesul de mortalitate în comparație cu ratele observate cu alte terapii cu agent hipoglicemic oral.
Rezumatul evenimentelor cardiovasculare grave (% din totalul pacienților cu evenimente) în teste care compară prandina cu sulfonilureele
| Prandin | SU | |
| Total expus | 1228 | 498 |
| Evenimente CV serioase | 4% | 3% |
| Evenimente ischemice cardiace | 2% | 2% |
| Decese cauzate de CV Events | 0.5% | 0.4% |
* gliburură și glipizidă
Șapte studii clinice controlate au inclus terapia combinată cu Prandin cu insulină NPH (n = 431), insulină formulări singure (n = 388) sau alte combinații (sulfonilurea plus NPH-insulină sau Prandin plus metformină) (N = 120). Au existat șase reacții adverse grave ale ischemiei miocardice la pacienții tratați cu Prandin plus NPH-insulină din două studii și un eveniment la pacienții care utilizează formulări de insulină singure de la altul studiu.
Evenimente adverse rare (<1% din pacienți)
Evenimente clinice sau de laborator adverse mai puțin frecvente observate în studiile clinice au inclus enzime hepatice crescute, trombocitopenie, leucopenie și reacții anafilactoide.
Deși nu a fost stabilită nici o relație de cauzalitate cu repaglinida, experiența post-comercializare include rapoarte dintre următoarele evenimente adverse: alopecie, anemie hemolitică, pancreatită, sindromul Stevens-Johnson și disfuncție hepatică severă, inclusiv icter și hepatită.
Terapia combinată cu Thiazolidinediones
În timpul tratamentului de 24 de săptămâni, studiile clinice cu terapia combinată cu Prandin-rosiglitazonă sau Prandin-pioglitazonă (un număr total de 250 de pacienți în terapia combinată), hipoglicemie (glicemie <50 mg / dL) a apărut la 7% dintre pacienții cu terapie combinată comparativ cu 7% pentru monoterapia cu Prandin și 2% pentru tiazolidinione în monoterapie.
Edemul periferic a fost raportat la 12 din 250 de pacienți cu terapie combinată Prandin-tiazolidinedione și 3 din 124 de pacienți cu monoterapie tiazolidinedione, fără cazuri raportate în aceste studii pentru Prandin în monoterapie. Atunci când este corectat pentru ratele de abandon ale grupurilor de tratament, procentul de pacienți care prezintă evenimente de edem periferic pe 24 săptămâni de tratament au fost 5% pentru terapia combinată cu Prandin-tiazolidinedione și 4% pentru tiazolidinione în monoterapie. Au fost raportate la 2 din 250 de pacienți (0,8%) tratați cu terapia cu Prandin-tiazolidinionee cu episoade de edem cu insuficiență cardiacă congestivă. Ambii pacienți au avut antecedente de boală coronariană și s-au recuperat după tratamentul cu agenți diuretici. Nu au fost raportate cazuri comparabile în grupurile de tratament de monoterapie.
Modificarea medie a greutății de la nivelul inițial a fost de +4,9 kg pentru terapia cu Prandin-tiazolidinedione. Nu au existat pacienți pe terapia combinată cu Prandin-tiazolidinione care au avut creșteri ale transaminazelor hepatice (definită ca fiind de 3 ori limita superioară a nivelurilor normale).
top
Supradozaj
Într-un studiu clinic, pacienții au primit doze crescânde de Prandin până la 80 mg pe zi timp de 14 zile. Au existat puține efecte adverse, altele decât cele asociate cu efectul intenționat de scădere a glicemiei. Hipoglicemia nu a apărut atunci când mesele au fost administrate cu aceste doze mari. Simptomele hipoglicemice fără pierderea cunoștinței sau descoperirile neurologice trebuie tratate agresiv cu glucoză orală și ajustări ale dozajului medicamentului și / sau a modelelor de masă. Monitorizarea atentă poate continua până când medicul este asigurat că pacientul nu este în pericol. Pacienții trebuie monitorizați îndeaproape timp de cel puțin 24 până la 48 de ore, deoarece hipoglicemia poate reapărea după recuperarea clinică aparentă. Nu există dovezi că repaglinida este dializabilă folosind hemodializă.
Reacțiile hipoglicemice severe cu comă, convulsii sau alte tulburări neurologice apar rar, dar constituie urgențe medicale care necesită spitalizare imediată. Dacă este diagnosticată sau suspectată coma hipoglicemică, pacientul trebuie să i se administreze o injecție intravenoasă rapidă de soluție concentrată de glucoză (50%). Aceasta trebuie să fie urmată de o perfuzie continuă de soluție de glucoză mai diluată (10%) la o viteză care să mențină glicemia la un nivel peste 100 mg / dL.
top
Dozaj si administrare
Nu există un regim de dozare fixă pentru tratamentul diabetului de tip 2 cu Prandin.
Glicemia pacientului trebuie monitorizată periodic pentru a determina doza minimă eficientă pentru pacient; pentru a detecta insuficiența primară, adică scăderea inadecvată a glicemiei la doza maximă recomandată de medicamente; și pentru a detecta insuficiența secundară, adică pierderea unui răspuns adecvat de scădere a glicemiei după o perioadă inițială de eficacitate. Nivelurile de hemoglobină glicozilată au valoare în monitorizarea răspunsului pe termen lung al pacientului la terapie.
Administrarea pe termen scurt a Prandinului poate fi suficientă în perioadele de pierdere tranzitorie a controlului la pacienții de obicei bine controlați în dietă.
Dozele de prandin sunt luate de obicei în 15 minute de la masă, dar timpul poate varia de la înaintea mesei până la 30 de minute înainte de masă.
Doza de pornire
Pentru pacienții care nu au fost tratați anterior sau al căror HbA1c este <8%, doza inițială trebuie să fie de 0,5 mg la fiecare masă. Pentru pacienții tratati anterior cu medicamente care reduc glucoza din sânge și a căror HbA1c este de ‰ ¥ 8%, doza inițială este de 1 sau 2 mg cu fiecare masă în mod prealabil (vezi paragraful anterior).
Reglarea dozei
Reglajele de dozare trebuie să fie determinate de răspunsul glicemiei, de regulă a glicemiei. Testarea nivelului de glucoză postprandial poate fi de ajutor clinic la pacienții ale căror niveluri de glucoză din sânge înainte de masă sunt satisfăcătoare, dar al căror control global al glicemiei (HbA1c) este inadecvat. Doza preprandială trebuie dublată până la 4 mg cu fiecare masă până când se obține un răspuns satisfăcător al glicemiei. Trebuie să treacă cel puțin o săptămână pentru a evalua răspunsul după fiecare ajustare a dozei.
Intervalul de doză recomandat este de la 0,5 mg la 4 mg, luat împreună cu mesele. Prandinul poate fi dozat în prealabil de 2, 3 sau de 4 ori pe zi, ca răspuns la modificările modelului de masă al pacientului. Doza maximă recomandată zilnic este de 16 mg.
Managementul pacientului
Eficacitatea pe termen lung trebuie monitorizată prin măsurarea nivelurilor de HbA1c aproximativ la fiecare 3 luni. Nerespectarea unui regim de dozare adecvat poate precipita hipoglicemia sau hiperglicemia. Pacienții care nu respectă regimul alimentar și medicamentele prescrise sunt mai predispuși să prezinte un răspuns nesatisfăcător la terapie, inclusiv hipoglicemie. Atunci când apare hipoglicemie la pacienții care iau o combinație de Prandin și tiazolidinione sau Prandin și metformină, doza de Prandin trebuie redusă.
Pacienții care primesc alți agenți hipoglicemici orali
Când Prandin este utilizat pentru a înlocui terapia cu alți agenți hipoglicemici orali, Prandin poate fi început a doua zi după administrarea dozei finale. Pacienții trebuie apoi observați cu atenție pentru hipoglicemie, datorită potențialelor suprapuneri ale efectelor medicamentoase. Atunci când sunt transferați de la agenți de sulfonilurea cu timpul de înjumătățire mai lung (de exemplu, clorpropamidă) la repaglinidă, monitorizarea atentă poate fi indicată până la o săptămână sau mai mult.
Terapia combinată
Dacă monoterapia cu Prandin nu are ca rezultat un control glicemic adecvat, se poate adăuga metformină sau o tiazolidinioneză. Dacă metoterapia sau tiazolidinedione monoterapia nu oferă un control adecvat, se poate adăuga Prandin. Reglarea inițială a dozei și a dozei pentru terapia combinată cu Prandin este aceeași ca pentru monoterapia cu Prandin. Doza fiecărui medicament trebuie ajustată cu atenție pentru a determina doza minimă necesară pentru a obține efectul farmacologic dorit. Nerespectarea acestui lucru poate duce la creșterea incidenței episoadelor hipoglicemice. Monitorizarea adecvată a măsurătorilor FPG și HbA1c trebuie utilizată pentru a asigura că pacientul nu este supus unei expuneri excesive la medicamente sau a unei probabilități mai mari de eșec secundar.
top
Cât este furnizat
Tabletele Prandin (repaglinide) sunt furnizate sub formă de tablete biconvexe nescurate, disponibile în concentrații de 0,5 mg (alb), 1 mg (galben) și 2 mg (piersic). Tabletele sunt gofrate cu simbolul taur Novo Nordisk (Apis) și colorate pentru a indica puterea.
| Comprimate 0,5 mg (alb) | Sticle de 100 | NDC 00169-0081-81 |
| Sticle de 500 | NDC 00169-0081-82 | |
| Sticle de 1000 | NDC 00169-0081-83 | |
| Comprimate de 1 mg (galben) | Sticle de 100 | NDC 00169-0082-81 |
| Sticle de 500 | NDC 00169-0082-82 | |
| Sticle de 1000 | NDC 00169-0082-83 | |
| Comprimate de 2 mg (piersică) | Sticle de 100 | NDC 00169-0084-81 |
| Sticle de 500 | NDC 00169-0084-82 | |
| Sticle de 1000 | NDC 00169-0084-83 |
Nu păstrați peste 25 ° C (77 ° F).
Protejați-vă de umiditate. Păstrați sticlele bine închise.
Aruncați în containere strânse cu închideri de siguranță.
Licențiat în conformitate cu brevetul SUA nr. RE 37.035.
Prandin® este marcă înregistrată a Novo Nordisk A / S.
Fabricat în Germania pentru
Novo Nordisk Inc.
Princeton, NJ 08540
1-800-727-6500
www.novonordisk-us.com
© 2003-2008 Novo Nordisk A / S
Prandin, informații despre pacient (în engleză simplă)
Informații detaliate despre semne, simptome, cauze, tratamente ale diabetului
ultima actualizare 06/2009
Informațiile din această monografie nu sunt destinate să acopere toate utilizările, indicațiile, precauțiile, interacțiunile medicamentoase sau efectele adverse posibile. Aceste informații sunt generalizate și nu sunt destinate unor sfaturi medicale specifice. Dacă aveți întrebări despre medicamentele pe care le luați sau doriți mai multe informații, consultați medicul, farmacistul sau asistenta medicală.
înapoi la: Căutați toate medicamentele pentru diabet



