Onglyza pentru tratamentul diabetului
Nume de marcă: Onglyza
Denumire generică: Saxagliptin
Forma de dozare: tableta, acoperită cu film
Cuprins:
Indicații și utilizare
Dozaj si administrare
Forme de dozare și forțe
Contraindicații
Avertismente și precauții
Reactii adverse
Interacțiunile medicamentoase
Utilizare în populații specifice
Supradozarea
Descriere
Farmacologie
Toxicologie nonclinică
Studii clinice
Cât este furnizat
Onglyza informații despre pacienți (în engleză simplă)
Indicații și utilizare
Monoterapie și terapie combinată
Onglyza este indicat ca adjuvant la dieta și exerciții fizice pentru a îmbunătăți controlul glicemic la adulții cu diabet zaharat de tip 2. [Vedea Studii clinice].
Limitări importante de utilizare
Onglyza nu trebuie utilizat pentru tratamentul diabetului zaharat tip 1 sau al cetoacidozei diabetice, deoarece nu ar fi eficient în aceste setări.
Onglyza nu a fost studiat în asociere cu insulina.
top
Dozaj si administrare
Dozare recomandată
Doza recomandată de Onglyza este de 2,5 mg sau 5 mg, o dată pe zi, indiferent de masă.
Pacienți cu insuficiență renală
Nu se recomandă ajustarea dozei pentru Onglyza la pacienții cu insuficiență renală ușoară (clearance al creatininei [CrCl]> 50 ml / min).
Doza de Onglyza este de 2,5 mg o dată pe zi pentru pacienții cu insuficiență renală moderată sau severă sau cu boală renală în stadiu final (ESRD) care necesită hemodializă (clearance al creatininei [CrCl] â ‰ ¤50 ml / min). Onglyza trebuie administrat după hemodializă. Onglyza nu a fost studiat la pacienții supuși dializei peritoneale.
Deoarece doza de Onglyza ar trebui să fie limitată la 2,5 mg pe baza funcției renale, se recomandă evaluarea funcției renale înainte de inițierea lui Onglyza și ulterior periodic. Funcția renală poate fi estimată din creatinina serică folosind formula Cockcroft-Gault sau Modificarea dietei în formula bolii renale. [Vedea Farmacologie clinică, Farmacocinetică.]
Inhibitori puternici CYP3A4 / 5
Doza de Onglyza este de 2,5 mg o dată pe zi, când se administrează concomitent cu inhibitori puternici ai citocromului P450 3A4 / 5 (CYP3A4 / 5) (de exemplu, ketoconazol, atazanavir, claritromicină, indinavir, itraconazol, nefazodonă, nelfinavir, ritonavir, saquinavir și telitromicina). [Vedea Interacțiunile medicamentoase, Inhibitori ai enzimelor CYP3A4 / 5 și Farmacologie clinică, Farmacocinetică.]
top
Forme de dozare și forțe
- Onglyza (saxagliptin) comprimate de 5 mg sunt comprimate roz, biconvexe, rotunde, filmate, cu „5” tipărite pe o parte și „4215”, imprimate pe verso, cu cerneală albastră.
- Comprimatele de Onglyza (saxagliptin) de 2,5 mg sunt galben pal până la galben deschis, comprimate biconvexe, rotunde, filmate, cu „2,5” tipărite pe o parte și „4214”, imprimate pe verso, cu cerneală albastră.
top
Contraindicații
Nici unul.
top
Avertismente și precauții
Utilizați cu medicamente cunoscute pentru a cauza hipoglicemie
Secretagogii de insulină, cum ar fi sulfonilureele, provoacă hipoglicemie. Prin urmare, poate fi necesară o doză mai mică de secretagog insulină pentru a reduce riscul de hipoglicemie atunci când este utilizat în combinație cu Onglyza. [Vedea Reactii adverse, Experiențe de studii clinice.]
Rezultate macrovasculare
Nu au existat studii clinice care să stabilească dovezi concludente privind reducerea riscului macrovascular cu Onglyza sau orice alt medicament antidiabetic.
top
Reactii adverse
Experiențe de studii clinice
Deoarece studiile clinice sunt efectuate în condiții variate, ratele de reacție adversă observate în studiile clinice ale a medicamentul nu poate fi comparat în mod direct cu ratele din studiile clinice ale unui alt medicament și poate să nu reflecte ratele observate în practică.
Monoterapie și terapie complementară complementară
În două studii de monoterapie controlate cu placebo, cu o durată de 24 de săptămâni, pacienții au fost tratați cu Onglyza 2,5 mg pe zi, Onglyza 5 mg pe zi și cu placebo. Au fost, de asemenea, efectuate trei teste combinate de 24 de săptămâni, controlate cu placebo, terapie combinată: unul cu metformină, unul cu tiazolidinione (pioglitazonă sau rosiglitazonă) și unul cu glicurură. În aceste trei studii, pacienții au fost randomizați la terapia suplimentară cu Onglyza 2,5 mg zilnic, Onglyza 5 mg zilnic sau placebo. Un braț de tratament cu saxagliptin 10 mg a fost inclus într-unul dintre studiile de monoterapie și în studiul de combinație suplimentară cu metformină.
Într-o analiză predefinită, combinată a datelor de 24 de săptămâni (indiferent de salvare glicemică) din cele două studii de monoterapie, suplimentul la studiul cu metformină, suplimentul la tiazolidinione (TZD), și adaosul la studiul cu gliburidă, incidența totală a evenimentelor adverse la pacienții tratați cu Onglyza 2,5 mg și Onglyza 5 mg a fost similară cu placebo (72,0% și 72,2% față de 70,6%, respectiv). Întreruperea terapiei din cauza evenimentelor adverse s-a produs la 2,2%, 3,3% și 1,8% dintre pacienții care au primit Onglyza 2,5 mg, Onglyza 5 mg și, respectiv, placebo. Cele mai frecvente reacții adverse (raportate la cel puțin 2 pacienți tratați cu Onglyza 2,5 mg sau la cel puțin 2 pacienți tratați cu Onglyza 5 mg) asociate cu întreruperea prematură a terapiei au inclus limfenie (0,1% și 0,5% față de 0%), erupții cutanate (0,2% și 0,3% comparativ cu 0,3%), creșterea creatininei din sânge (0,3% și 0% față de 0%) și creșterea fosfinozasei creatine din sânge (0,1% și 0,2% față de 0%). Reacțiile adverse din această analiză colectată raportate (indiferent de evaluarea cauzalității de către investigator) în 2008 ‰ ¥ 5% dintre pacienții tratați cu Onglyza 5 mg și mai frecvent decât la pacienții tratați cu placebo sunt arătați în Tabelul 1.
Tabelul 1: Reacții adverse (indiferent de evaluarea cauzalității de către investigator) în studiile controlate cu placebo * Raportat în ‰ ¥ 5% dintre pacienții tratați cu Onglyza 5 mg și mai frecvent decât la pacienții tratați cu placebo
| Numărul (%) de pacienți | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
placebo N = 799 |
|
| * Cele 5 studii controlate cu placebo includ două studii de monoterapie și un studiu suplimentar de terapie combinată, cu fiecare dintre următoarele: metformin, tiazolidinione sau glicburidă. Tabelul prezintă date de 24 de săptămâni, indiferent de salvarea glicemică. | ||
| Infectia tractului respirator superior | 68 (7.7) | 61 (7.6) |
| Infecții ale tractului urinar | 60 (6.8) | 49 (6.1) |
| Durere de cap | 57 (6.5) | 47 (5.9) |
La pacienții tratati cu Onglyza 2,5 mg, durerea de cap (6,5%) a fost singura reacție adversă raportată la o rată â ¥ 5% și mai frecvent decât la pacienții tratati cu placebo.
În această analiză colectată, reacțiile adverse care au fost raportate la 2% dintre pacienții tratați cu Onglyza 2,5 mg sau Onglyza 5 mg și 1% mai frecvent în comparație cu placebo au inclus: sinuzita (2,9% și 2,6% față de 1,6%, respectiv), dureri abdominale (2,4% și 1,7% față de 0,5%), gastroenterită (1,9% și 2,3% față de 0,9%) și vărsături (2,2% și 2,3% față de 1,3% ).
În suplimentul la studiul TZD, incidența edemului periferic a fost mai mare pentru Onglyza 5 mg față de placebo (8,1% și, respectiv, 4,3%). Incidența edemului periferic pentru Onglyza 2,5 mg a fost de 3,1%. Niciuna dintre reacțiile adverse raportate ale edemului periferic nu a dus la întreruperea medicamentului de studiu. Ratele de edem periferic pentru Onglyza 2,5 mg și Onglyza 5 mg față de placebo au fost 3,6% și 2% față de 3% administrate ca monoterapie, 2,1% și 2,1% față de 2,2% administrate ca terapie suplimentară metforminei și 2,4% și 1,2% față de 2,2% administrate ca terapie suplimentară la gliburidei.
Rata de incidență a fracturilor a fost de 1,0 și 0,6 la 100 de pacienți ani, respectiv, pentru Onglyza (analiza combinată de 2,5 mg, 5 mg și 10 mg) și placebo. Rata incidenței evenimentelor de fractură la pacienții care au primit Onglyza nu a crescut în timp. Cauzalitatea nu a fost stabilită și studiile nonclinice nu au demonstrat efecte adverse ale saxagliptinei asupra oaselor.
În programul clinic a fost observat un eveniment de trombocitopenie, în concordanță cu un diagnostic de purpură trombocitopenică idiopatică. Relația acestui eveniment cu Onglyza nu este cunoscută.
Reacții adverse asociate cu Onglyza administrate în comun cu Metformin la pacienții naivi cu tratament cu diabet zaharat de tip 2
Tabelul 2 prezintă reacțiile adverse raportate (indiferent de evaluarea cauzalității de către investigator) la 5% dintre pacienți participarea la un studiu suplimentar de 24 de săptămâni, controlat activ cu Onglyza și metformin coadministrate în tratamentul naiv pacienți.
Tabelul 2: Terapia inițială cu combinația de Onglyza și Metformin la pacienții naivi de tratament: reacții adverse raportate (indiferent de evaluarea investigatorului de cauzalitate) la ‰ ¥ 5% din pacienții tratați cu terapie combinată de Onglyza 5 mg Plus metformină (și mai frecvent decât la pacienții tratați cu metformină) Singur)
| Numărul (%) de pacienți | ||
|---|---|---|
| Onglyza 5 mg + Metformin * N = 320 |
Metformin * N = 328 |
|
| * Metformin a fost inițiată la o doză inițială de 500 mg pe zi și titrată până la maximum 2000 mg pe zi. | ||
| Durere de cap | 24 (7.5) | 17 (5.2) |
| rinofaringita | 22 (6.9) | 13 (4.0) |
hipoglicemia
Reacțiile adverse ale hipoglicemiei s-au bazat pe toate rapoartele de hipoglicemie; nu a fost necesară o măsurare concomitentă a glicemiei. În studiul suplimentar la glicuridă, incidența globală a hipoglicemiei raportate a fost mai mare pentru Onglyza 2,5 mg și Onglyza 5 mg (13,3% și 14,6%) față de placebo (10,1%). Incidența hipoglicemiei confirmate în acest studiu, definită ca simptome de hipoglicemie însoțită de a valoarea glicemiei în degete de â50 μ50 mg / dL, a fost de 2,4% și 0,8% pentru Onglyza 2,5 mg și Onglyza 5 mg și 0,7% pentru placebo. Incidența hipoglicemiei raportate pentru Onglyza 2,5 mg și Onglyza 5 mg față de placebo administrate ca monoterapie a fost de 4,0% și 5,6% față de 4,1%, respectiv, 7,8% și 5,8% față de 5% administrate ca terapie suplimentară metforminei și 4,1% și 2,7% față de 3,8% administrate ca terapie suplimentară TZD. Incidența hipoglicemiei raportate a fost de 3,4% la pacienții naivi tratați, care au primit Onglyza 5 mg plus metformină și 4,0% la pacienții care au primit metformină numai.
Reactii de hipersensibilitate
Evenimente legate de hipersensibilitate, cum ar fi urticarie și edem facial în analiza combinată cu 5 studii până în săptămâna 24 au fost raportate la 1,5%, 1,5% și 0,4% dintre pacienții care au primit Onglyza 2,5 mg, Onglyza 5 mg și placebo, respectiv. Niciunul dintre aceste evenimente la pacienții care au primit Onglyza nu a necesitat spitalizare sau au fost raportați ca fiind în pericol de viață de către investigatori. Un pacient tratat cu saxagliptin în această analiză colectată a fost întrerupt din cauza urticariei generalizate și a edemului facial.
Semnele vitale
Nu au fost observate modificări semnificative clinic ale semnelor vitale la pacienții tratați cu Onglyza.
Teste de laborator
Numărurile limfocitelor absolute
S-a observat o scădere medie legată de doză a numărului absolut de limfocite observat cu Onglyza. De la un nivel mediu de referință, limfocite absolute de aproximativ 2200 celule / microL, scăderi medii de aproximativ 100 și 120 celule / microL cu Onglyza 5 mg și, respectiv, 10 mg, comparativ cu placebo au fost observate la 24 de săptămâni într-o analiză colectată a cinci clinice controlate cu placebo Studii. Efecte similare au fost observate atunci când Onglyza 5 mg a fost administrat în combinație inițială cu metformină, comparativ cu metformin singur. Nu a fost observată nicio diferență pentru Onglyza 2,5 mg în raport cu placebo. Proporția pacienților cărora li sa raportat un număr de limfocite 7750 celule / microL a fost de 0,5%, 1,5%, 1,4% și 0,4% în grupurile de saxagliptin 2,5 mg, 5 mg, 10 mg și, respectiv, grupuri placebo. La majoritatea pacienților, nu a fost observată reapariția cu expunere repetată la Onglyza, deși unii pacienți au avut scăderi recurente la rechallenge care a dus la întreruperea Onglyza. Scăderea numărului de limfocite nu a fost asociată cu reacții adverse relevante din punct de vedere clinic.
Nu este cunoscută semnificația clinică a acestei scăderi a numărului de limfocite în raport cu placebo. Atunci când este indicat clinic, cum ar fi în condiții de infecție neobișnuită sau prelungită, trebuie măsurat numărul limfocitelor. Nu se cunoaște efectul Onglyza asupra numărului de limfocite la pacienții cu anomalii ale limfocitelor (de exemplu, virusul imunodeficienței umane).
trombocitele
Onglyza nu a demonstrat un efect clinic semnificativ sau consecvent asupra numărului de trombocite în cele șase studii dublu-orb, controlate de siguranță și eficacitate clinică.
top
Interacțiunile medicamentoase
Inductori de enzime CYP3A4 / 5
Rifampin a scăzut în mod semnificativ expunerea la saxagliptin fără nicio modificare a zonei sub curba de concentrare în timp (ASC) a metabolitului său activ, 5-hidroxi saxagliptin. Inhibarea activității plasmatice a dipeptidil-peptidazei-4 (DPP4) pe un interval de doză de 24 de ore nu a fost afectată de rifampină. Prin urmare, ajustarea dozei de Onglyza nu este recomandată. [Vedea Farmacologie clinică, Farmacocinetică.]
Inhibitori ai enzimelor CYP3A4 / 5
Inhibitori moderati ai CYP3A4 / 5
Diltiazem a crescut expunerea saxagliptin. Creșteri similare ale concentrațiilor plasmatice de saxagliptin sunt anticipate în prezența altor CYP3A4 / 5 moderate inhibitori (de exemplu, amprenavir, aprepitant, eritromicină, fluconazol, fosamprenavir, suc de grapefruit și verapamil); cu toate acestea, ajustarea dozei de Onglyza nu este recomandată. [Vedea Farmacologie clinică, Farmacocinetică.]
Inhibitori puternici ai CYP3A4 / 5
Ketoconazolul a crescut semnificativ expunerea la saxagliptin. Creșterea semnificativă similară a concentrațiilor plasmatice de saxagliptin este prevăzută cu alți inhibitori puternici ai CYP3A4 / 5 (de exemplu, atazanavir, claritromicină, indinavir, itraconazol, nefazodonă, nelfinavir, ritonavir, saquinavir și telitromicina). Doza de Onglyza ar trebui limitată la 2,5 mg atunci când se administrează concomitent cu un inhibitor puternic de CYP3A4 / 5. [Vedea Dozaj si administrare, Inhibitori puternici CYP3A4 / 5 și Farmacologie clinică, Farmacocinetică.]
top
Utilizare în populații specifice
graviditate
Sarcina Categoria B
Nu există studii adecvate și bine controlate la gravide. Deoarece studiile asupra reproducerii la animale nu sunt întotdeauna predictive pentru răspunsul uman, Onglyza, ca și alte medicamente antidiabetice, trebuie utilizat în timpul sarcinii numai dacă este necesar în mod clar.
Saxagliptin nu a fost teratogenă în nicio doză testată atunci când a fost administrată la șobolani și iepuri gravide în perioadele de organogeneză. Osificarea incompletă a pelvisului, o formă de întârziere de dezvoltare, a avut loc la șobolani la o doză de 240 mg / kg, sau aproximativ 1503 și de 66 de ori expunerea umană la saxagliptin și respectiv la metabolitul activ, la doza maximă recomandată de om (MRHD) de 5 mg. Toxicitatea maternă și reducerea greutăților corpului fetal au fost observate la 7986 și de 328 ori expunerea umană la MRHD pentru saxagliptin și, respectiv, metabolitul activ. Variații scheletice minore la iepuri au apărut la o doză toxică maternă de 200 mg / kg, sau de aproximativ 1432 și 992 ori mai mare decât MRHD. Când a fost administrat la șobolani în combinație cu metformină, saxagliptina nu a fost teratogenă sau embrioletală la expuneri de 21 de ori mai mult decât saxagliptin MRHD. Administrarea combinată de metformin cu o doză mai mare de saxagliptin (de 109 ori mai mare decât saxagliptin MRHD) a fost asociată cu craniorachischisis (un defect rar al tubului neural caracterizat prin închiderea incompletă a craniului și a coloanei vertebrale) la două fături de la o baraj unic. Expunerile de metformină în fiecare combinație au fost de 4 ori expunerea umană de 2000 mg pe zi.
Saxagliptina administrată la șobolani de sex feminin din ziua de gestație 6 până în ziua de alăptare 20 a dus la scăderea greutăților corporale la bărbați și descendenți de sex feminin numai în doze toxice materne (expuneri - 1629 și de 53 de ori saxagliptin și metabolitul său activ la DMRO). Nu a fost observată nicio toxicitate funcțională sau comportamentală la urmașii de șobolani administrați saxagliptin în nici o doză.
Saxagliptin încrucișează placenta în făt în urma administrării la șobolani gravide.
Mamele care alăptează
Saxagliptina este secretată în laptele șobolanilor care alăptează la un raport aproximativ 1: 1 cu concentrații de medicamente plasmatice. Nu se știe dacă saxagliptina este secretată în laptele uman. Deoarece multe medicamente sunt secretate în laptele uman, trebuie luată prudență atunci când Onglyza este administrat unei femei care alăptează.
Utilizare pediatrică
Nu a fost stabilită siguranța și eficacitatea Onglyza la pacienții pediatri.
Utilizare geriatrică
În cele șase studii clinice dublu-orb, controlate de siguranță și eficacitate ale Onglyza, 634 (15,3%) dintre cei 4148 pacienți randomizați au fost de 65 de ani și peste, iar 59 (1,4%) pacienți aveau 75 de ani și peste. Nu au fost observate diferențe generale de siguranță sau eficacitate între pacienții de 65 de ani și cei mai tineri. Deși această experiență clinică nu a identificat diferențe de răspuns între pacienții vârstnici și cei mai tineri, nu poate fi exclusă o sensibilitate mai mare a unor persoane în vârstă.
Saxagliptina și metabolitul său activ sunt eliminate în parte de către rinichi. Deoarece pacienții vârstnici au o probabilitate mai mare de a reduce funcția renală, trebuie să se acorde atenție la selecția dozei la vârstnici, pe baza funcției renale. [Vedea Dozaj si administrare, Pacienți cu insuficiență renală și Farmacologie clinică, Farmacocinetică.]
top
Supradozarea
În cadrul unui studiu clinic controlat, o dată pe zi, Onglyza administrat oral la subiecți sănătoși, în doze de până la 400 mg pe zi timp de 2 săptămâni (De 80 de ori MRHD) nu a avut reacții adverse clinice legate de doză și niciun efect clinic semnificativ asupra intervalului QTc sau a inimii rată.
În caz de supradozaj, trebuie inițiat un tratament adecvat de susținere, așa cum este dictat de starea clinică a pacientului. Saxagliptin și metabolitul său activ sunt îndepărtate prin hemodializă (23% din doză peste 4 ore).
top
Descriere
Saxagliptin este un inhibitor activ oral al enzimei DPP4.
Saxagliptin monohidrat este descris chimic ca (1S, 3S, 5S) -2 - [(2S) -2-Amino-2- (3-hidroxitriciclo [3.3.1.13,7] dec-1-il) acetil] -2-azabiciclo [3.1.0] hexan-3-carbonitril, monohidrat sau (1S, 3S, 5S) - 2 - [(2S) - 2 - Amino - 2 - (3 - hidroxyadamantan - 1 - il) acetil] - 2 - azabiciclo [3.1.0] hexan - 3 - carbonitril hidrat. Formula empirică este C18H25N3O2-H2O și greutatea moleculară este 333,43. Formula structurală este:

Saxagliptin monohidratul este o pulbere cristalină albă până la galben deschis sau maro deschis, neigroscopic. Este puțin solubil în apă la 24 ° C ± 3 ° C, ușor solubil în acetat de etil și solubil în metanol, etanol, alcool izopropilic, acetonitril, acetonă și polietilenglicol 400 (PEG 400).
Fiecare comprimat filmat de Onglyza pentru utilizare orală conține fie 2,79 mg saxagliptin clorhidrat (anhidru) echivalent cu 2,5 mg saxagliptin sau 5,58 mg saxagliptin clorhidrat (anhidru) echivalent cu 5 mg saxagliptin și următoarele ingrediente inactive: lactoză monohidrat, celuloză microcristalină, croscarmeloză sodică și stearat de magneziu. În plus, acoperirea cu film conține următoarele ingrediente inactive: alcool polivinilic, polietilenglicol, dioxid de titan, talc și oxizi de fier.
top
Farmacologie clinică
Mecanism de acțiune
Concentrații crescute ale hormonilor incretinei, cum ar fi peptida-1 asemănătoare glucagonului (GLP-1) și dependentă de glucoză polipeptidul insulinotrop (GIP) este eliberat în fluxul sanguin din intestinul subțire ca răspuns la mese. Acești hormoni determină eliberarea insulinei din celulele beta pancreatice într-un mod dependent de glucoză, dar sunt inactivate de enzima dipeptidil-peptidază-4 (DPP4) în câteva minute. GLP-1 reduce, de asemenea, secreția de glucagon din celulele alfa pancreatice, reducând producția de glucoză hepatică. La pacienții cu diabet zaharat de tip 2, concentrațiile de GLP-1 sunt reduse, dar răspunsul la insulină la GLP-1 este păstrat. Saxagliptina este un inhibitor competitiv al DPP4 care încetinește inactivarea hormonilor incretinei, crescând astfel fluxul sanguin concentrații și reducerea concentrațiilor de glucoză postprandiale și postprandiale într-un mod dependent de glucoză la pacienții cu diabet zaharat tip 2 zaharat.
Farmacodinamica
La pacienții cu diabet zaharat de tip 2, administrarea de Onglyza inhibă activitatea enzimei DPP4 pentru o perioadă de 24 de ore. După o încărcătură orală de glucoză sau o masă, această inhibare a DPP4 a dus la o creștere de 2- 3 ori a nivelului circulant al activului GLP-1 și GIP, scăderea concentrațiilor de glucagon și creșterea secreției de insulină dependentă de glucoză din celulele beta pancreatice. Creșterea insulinei și scăderea glucagonului au fost asociate cu concentrații mai scăzute de glucoză în post și reducerea excursiei de glucoză după o încărcătură orală de glucoză sau o masă.
Electrofiziologie cardiacă
Într-un studiu de comparatie activ, randomizat, dublu-orb, controlat cu placebo, în 4 căi, folosind moxifloxacină la 40 de subiecți sănătoși, Onglyza nu a fost asociat cu prelungirea semnificativă clinic a intervalului QTc sau cu frecvența cardiacă la doze zilnice până la 40 mg (de 8 ori DMRO).
Farmacocinetica
Farmacocinetica saxagliptinei și a metabolitului său activ, 5-hidroxi saxagliptin au fost similare la subiecții sănătoși și la pacienții cu diabet zaharat tip 2. Cmax și valorile ASC ale saxagliptinei și metabolitului său activ au crescut proporțional în intervalul dozei de 2,5 până la 400 mg. După o doză orală unică de 5 mg de saxagliptin la subiecți sănătoși, valorile medii ASC plasmatice pentru saxagliptin și metabolitul său activ au fost 78 ng-h / mL și 214 ng-h / mL. Plasma corespunzătoare Cmax valorile au fost 24 ng / ml și respectiv 47 ng / ml. Variabilitatea medie (% CV) pentru ASC și Cmax atât pentru saxagliptin cât și pentru metabolitul său activ a fost mai mic de 25%.
Nu s-a observat o acumulare apreciabilă a saxagliptinei sau a metabolitului său activ cu dozarea repetată o dată pe zi la un nivel de doză. Nu s-a observat nicio dependență de doză și de timp în eliberarea saxagliptinei și a metabolitului său activ pe parcursul a 14 zile de administrare o dată pe zi cu saxagliptin în doze cuprinse între 2,5 și 400 mg.
Absorbţie
Timpul mediu până la concentrație maximă (Tmax) după administrarea de 5 mg o dată pe zi a fost de 2 ore pentru saxagliptin și 4 ore pentru metabolitul său activ. Administrarea cu o masă bogată în grăsimi a determinat o creștere a Tmax de saxagliptin cu aproximativ 20 de minute în comparație cu condițiile postite. S-a înregistrat o creștere de 27% a ASC a saxagliptinei în cazul administrării cu o masă comparativ cu condițiile de post. Onglyza poate fi administrat cu sau fără alimente.
distribuire
Legarea proteinei in vitro a saxagliptinei și metabolitul său activ în serul uman este neglijabilă. Prin urmare, nu se așteaptă ca modificările nivelului de proteine din sânge în diferite stări de boală (de exemplu, insuficiență renală sau hepatică) să nu modifice dispoziția saxagliptinei.
Metabolism
Metabolizarea saxagliptinei este mediată în principal de citocromul P450 3A4 / 5 (CYP3A4 / 5). Principalul metabolit al saxagliptinei este, de asemenea, un inhibitor al DPP4, care este la jumătate la fel de puternic ca saxagliptin. Prin urmare, inhibitorii și inductorii puternici ai CYP3A4 / 5 vor modifica farmacocinetica saxagliptinei și metabolitul activ al acesteia. [Vedea Interacțiunile medicamentoase.]
Excreţie
Saxagliptina este eliminată atât pe căile renale, cât și pe cele hepatice. După o singură doză de 50 mg 14C-saxagliptin, 24%, 36% și 75% din doză au fost excretați în urină sub formă de saxagliptin, metabolitul său activ și respectiv radioactivitate totală. Clearance-ul mediu renal al saxagliptinei (~ 230 ml / min) a fost mai mare decât rata medie de filtrare glomerulară estimată (~ 120 ml / min), ceea ce sugerează o excreție renală activă. Un total de 22% din radioactivitatea administrată a fost recuperată în materiile fecale reprezentând fracția din doza de saxagliptin excretată în bilă și / sau medicamentul neabsorbit din tractul gastro-intestinal. După o singură doză orală de Onglyza 5 mg la subiecți sănătoși, timpul de înjumătățire plasmatică mediu plasmatic (t1/2) pentru saxagliptin și metabolitul său activ a fost 2,5 și, respectiv, 3,1 ore.
Populații specifice
Insuficiență renală
Un studiu cu o singură doză deschisă a fost efectuat pentru a evalua farmacocinetica saxagliptinei (doză de 10 mg) în subiecți cu diferite grade de insuficiență renală cronică (N = 8 pe grup) în comparație cu subiecții cu rinichi normal funcţie. Studiul a inclus pacienți cu insuficiență renală clasificați pe baza clearance-ului creatininei ca fiind ușori (> 50 până la â € 80 mL / min), moderat (30 până la ‰50 ml / min) și sever (<30 ml / min), precum și pacienții cu boală renală în stadiu final la hemodializă. Clearance-ul creatininei a fost estimat din creatinina serică pe baza formulei Cockcroft-Gault:
CrCl = [vârsta de 140 de ani (ani)] greutate (kg) {× 0,85 pentru pacienții de sex feminin}
[72 Ã creatinină serică (mg / dL)]
Gradul de afectare renală nu a afectat Cmax saxagliptin sau metabolitul său activ. La subiecții cu insuficiență renală ușoară, valorile ASC ale saxagliptinei și metabolitului său activ au fost cu 20% și, respectiv, 70% mai mari decât valorile ASC la pacienții cu funcție renală normală. Deoarece creșterile de această magnitudine nu sunt considerate relevante din punct de vedere clinic, nu este recomandată ajustarea dozei la pacienții cu insuficiență renală ușoară. La subiecții cu insuficiență renală moderată sau severă, valorile ASC ale saxagliptin și active ale acesteia metabolit au fost de până la 2,1 și respectiv 4,5 ori mai mari decât valorile ASC la subiecții cu rinichi normal funcţie. Pentru a realiza expuneri plasmatice de saxagliptin și metabolitul său activ similare celor la pacienții cu funcție renală normală, doza recomandată este de 2,5 mg o dată pe zi la pacienții cu insuficiență renală moderată și severă, precum și la pacienții cu boală renală în stadiu final care necesită hemodializă. Saxagliptina este îndepărtată prin hemodializă.
Deficiență hepatică
La subiecții cu insuficiență hepatică (clasele A, B și C) Child-Pugh, înseamnă Cmax și ASC de saxagliptin au fost cu până la 8% și, respectiv, 77% mai mari, comparativ cu controalele potrivite sănătoase după administrarea unei singure doze de 10 mg de saxagliptin. C corespunzătormax și ASC a metabolitului activ au fost cu până la 59% și respectiv 33% mai mici, comparativ cu controalele potrivite sănătoase. Aceste diferențe nu sunt considerate semnificative din punct de vedere clinic. Nu este recomandată ajustarea dozei la pacienții cu insuficiență hepatică.
Indicele de masa corporala
Nu se recomandă ajustarea dozelor pe baza indicelui de masă corporală (IMC) care nu a fost identificat ca semnificativ covariate la clearance-ul aparent de saxagliptin sau metabolitul său activ în farmacocinetica populației analiză.
Sex
Nu se recomandă ajustarea dozelor în funcție de sex. Nu au fost observate diferențe în farmacocinetica saxagliptinei între bărbați și femei. În comparație cu bărbații, femeile au avut valori de expunere cu aproximativ 25% mai mari pentru metabolitul activ decât bărbații, dar este puțin probabil ca această diferență să aibă o relevanță clinică. Genul nu a fost identificat ca un covariabil semnificativ la clearance-ul aparent de saxagliptin și metabolitul său activ în analiza farmacocinetică a populației.
geriatrie
Nu se recomandă ajustarea dozei numai pe baza vârstei. Subiecții vârstnici (65-80 ani) au avut media geometrică C cu 23% și 59% mai maremax și valorile geometrice medii ale ASC, pentru saxagliptin decât subiecții tineri (18-40 ani). Diferențele în farmacocinetica activă a metabolitului între subiecții vârstnici și tineri au reflectat în general diferențele observate în farmacocinetica saxagliptinei. Diferența dintre farmacocinetica saxagliptinei și metabolitul activ la tineri și vârstnici subiecții se datorează probabil mai multor factori, inclusiv scăderea funcției renale și a capacității metabolice creșterea vârstei. Vârsta nu a fost identificată ca o covariate semnificativă la clearance-ul aparent de saxagliptin și metabolitul său activ în analiza farmacocinetică a populației
de pediatrie
Nu au fost efectuate studii care caracterizează farmacocinetica saxagliptinei la pacienții pediatri.
Rasă și etnie
Nu se recomandă ajustarea dozei în funcție de rasă. Analiza farmacocinetică a populației a comparat farmacocinetica saxagliptinei și cea activă a acesteia metabolit la 309 subiecți caucazieni cu 105 subiecți necaucazieni (constând din șase rasiale grupuri). Nu a fost detectată nicio diferență semnificativă în farmacocinetica saxagliptinei și a metabolitului său activ între aceste două populații.
Interacțiunile medicament-drog
Evaluarea in vitro a interacțiunilor medicamentoase
Metabolizarea saxagliptinei este mediată în primul rând de CYP3A4 / 5.
În studiile in vitro, saxagliptin și metabolitul său activ nu au inhibat CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 sau 3A4 sau au indus CYP1A2, 2B6, 2C9 sau 3A4. Prin urmare, saxagliptin nu este de așteptat să modifice eliminarea metabolică a medicamentelor administrate în comun, care sunt metabolizate de aceste enzime. Saxagliptina este un substrat P-glicoproteină (P-gp), dar nu este un inhibitor sau un inductor semnificativ al P-gp.
Legarea proteinei in vitro a saxagliptinei și metabolitul său activ în serul uman este neglijabilă. Astfel, legarea de proteine nu ar avea o influență semnificativă asupra farmacocineticii saxagliptinei sau a altor medicamente.
În evaluarea Vivo a interacțiunilor medicamentoase
Efectele saxagliptinei asupra altor medicamente
În studiile efectuate la subiecți sănătoși, așa cum este descris mai jos, saxagliptin nu a modificat în mod semnificativ farmacocinetica metforminei, glicuridei, pioglitazonei, digoxinei, simvastatinei, diltiazemului sau ketoconazolului.
Metformin: Administrarea concomitentă a unei singure doze de saxagliptin (100 mg) și metformin (1000 mg), un substrat hOCT-2, nu a modificat farmacocinetica metforminei la subiecții sănătoși. Prin urmare, Onglyza nu este un inhibitor al transportului mediat de hOCT-2.
Glicuridă: administrarea concomitentă a unei singure doze de saxagliptin (10 mg) și glicburidă (5 mg), un substrat CYP2C9, a crescut plasma Cmax de glicurură cu 16%; cu toate acestea, ASC al glicurburii a fost neschimbat. Prin urmare, Onglyza nu inhibă în mod semnificativ metabolismul mediat de CYP2C9.
Pioglitazona: administrarea concomitentă a mai multor doze o dată pe zi de saxagliptin (10 mg) și pioglitazonă (45 mg), un substrat CYP2C8, a crescut plasma Cmax de pioglitazonă cu 14%; cu toate acestea, ASC de pioglitazonă a fost neschimbat.
Digoxin: Administrarea concomitentă a mai multor doze o dată pe zi de saxagliptin (10 mg) și digoxină (0,25 mg), un substrat P-gp, nu a modificat farmacocinetica digoxinei. Prin urmare, Onglyza nu este un inhibitor sau un inductor al transportului mediat de P-gp.
Simvastatină: administrarea concomitentă a mai multor doze o dată pe zi de saxagliptin (10 mg) și simvastatină (40 mg), un substrat CYP3A4 / 5, nu a modificat farmacocinetica simvastatinei. Prin urmare, Onglyza nu este un inhibitor sau un inductor al metabolismului mediat de CYP3A4 / 5.
Diltiazem: administrarea concomitentă a mai multor doze o dată pe zi de saxagliptin (10 mg) și diltiazem (formulare cu acțiune lungă de 360 mg în stare de echilibru), un inhibitor moderat al CYP3A4 / 5, a crescut plasma Cmax de diltiazem cu 16%; cu toate acestea, ASC a diltiazemului a fost neschimbat.
Ketoconazol: administrarea concomitentă a unei singure doze de saxagliptin (100 mg) și a mai multor doze de ketoconazol (200 mg la fiecare 12 ore la starea de echilibru), un puternic inhibitor al CYP3A4 / 5 și P-gp, a scăzut Cmax și ASC plasmatice ale ketoconazolului cu 16% și 13%, respectiv.
Efectele altor medicamente asupra saxagliptinei
Metformin: administrarea concomitentă a unei doze unice de saxagliptin (100 mg) și metformin (1000 mg), un substrat de hOCT-2, a scăzut Cmax de saxagliptin cu 21%; cu toate acestea, ASC a fost neschimbat.
Glicuridă: administrarea concomitentă a unei singure doze de saxagliptin (10 mg) și glicburidă (5 mg), un substrat CYP2C9, a crescut Cmax de saxagliptin cu 8%; cu toate acestea, ASC de saxagliptin a fost neschimbat.
Pioglitazona: administrarea concomitentă a mai multor doze o dată pe zi de saxagliptin (10 mg) și pioglitazonă (45 mg), un substrat CYP2C8 (major) și CYP3A4 (minor), nu au modificat farmacocinetica saxagliptin.
Digoxin: Administrarea concomitentă a mai multor doze o dată pe zi de saxagliptin (10 mg) și digoxină (0,25 mg), un substrat P-gp, nu a modificat farmacocinetica saxagliptinei.
Simvastatină: administrarea concomitentă a mai multor doze o dată pe zi de saxagliptin (10 mg) și simvastatină (40 mg), un substrat CYP3A4 / 5, a crescut Cmax de saxagliptin cu 21%; cu toate acestea, ASC de saxagliptin a fost neschimbat.
Diltiazem: administrarea concomitentă a unei singure doze de saxagliptin (10 mg) și diltiazem (formulare cu acțiune lungă de 360 mg în stare de echilibru), un inhibitor moderat al CYP3A4 / 5, a crescut Cmax de saxagliptin cu 63% și ASC de 2,1 ori. Aceasta a fost asociată cu o scădere corespunzătoare a Cmax și ASC a metabolitului activ cu 44% și, respectiv, 36%.
Ketoconazol: administrarea concomitentă a unei singure doze de saxagliptin (100 mg) și ketoconazol (200 mg la fiecare 12 ore în stare de echilibru), un puternic inhibitor al CYP3A4 / 5 și P-gp, a crescut Cmax pentru saxagliptin cu 62% și ASC de 2,5 ori. Aceasta a fost asociată cu o scădere corespunzătoare a Cmax și ASC a metabolitului activ cu 95% și, respectiv, 91%.
Într-un alt studiu, administrarea concomitentă a unei singure doze de saxagliptin (20 mg) și ketoconazol (200 mg la fiecare 12 ore în stare de echilibru) a crescut Cmax și ASC de saxagliptin de 2,4 ori, respectiv 3,7 ori. Aceasta a fost asociată cu o scădere corespunzătoare a Cmax și ASC a metabolitului activ cu 96%, respectiv 90%.
Rifampin: administrarea concomitentă a unei singure doze de saxagliptin (5 mg) și rifampină (600 mg QD în stare de echilibru) a scăzut Cmax și ASC de saxagliptin cu 53% și, respectiv, 76%, cu o creștere corespunzătoare a Cmax (39%), dar nici o modificare semnificativă în ASC plasmatic al metabolitului activ.
Omeprazol: administrarea concomitentă a mai multor doze o dată pe zi de saxagliptin (10 mg) și omeprazol (40 mg), un CYP2C19 (major) și substratul CYP3A4, un inhibitor al CYP2C19 și un inductor al MRP-3, nu au modificat farmacocinetica saxagliptin.
Hidroxid de aluminiu + hidroxid de magneziu + simeticonă: administrarea concomitentă a unei singure doze de saxagliptin (10 mg) și lichidul care conține hidroxid de aluminiu (2400 mg), hidroxid de magneziu (2400 mg) și simeticona (240 mg) au scăzut Cmax de saxagliptin cu 26%; cu toate acestea, ASC de saxagliptin a fost neschimbat.
Famotidină: administrarea unei singure doze de saxagliptin (10 mg) la 3 ore după o doză unică de famotidină (40 mg), un inhibitor al hOCT-1, hOCT-2 și hOCT-3, a crescut Cmax de saxagliptin cu 14%; cu toate acestea, ASC de saxagliptin a fost neschimbat.
top
Toxicologie nonclinică
Carcinogeneza, mutageneza, afectarea fertilitatii
Saxagliptin nu a indus tumori la șoareci (50, 250 și 600 mg / kg) sau la șobolani (25, 75, 150 și 300 mg / kg) la cele mai mari doze evaluate. Cele mai mari doze evaluate la șoareci au fost echivalente cu aproximativ 870 (bărbați) și 1165 (femei) ori expunerea umană la MRHD de 5 mg / zi. La șobolani, expunerile au fost de aproximativ 355 (bărbați) și 2217 (femei) ori de MRHD.
Saxagliptin nu a fost mutagenă sau clastogenă cu sau fără activare metabolică într-un test bacterian Ames in vitro, un test citogenetic in vitro la omul primar limfocite, un test oral in vivo de micronucleu la șobolani, un studiu de reparare a ADN-ului oral in vivo la șobolani și un studiu de citogenetică orală in vivo / in vitro la sângele periferic la șobolan limfocite. Metabolitul activ nu a fost mutagen într-o analiză bacteriană Ames in vitro.
Într-un studiu de fertilitate la șobolan, bărbații au fost tratați cu doze de gavaj oral timp de 2 săptămâni înainte de împerechere, în timpul împerecherii și până la programare terminarea (aproximativ 4 săptămâni în total) și femelele au fost tratate cu doze de gavaj oral timp de 2 săptămâni înainte de împerechere prin gestație ziua 7 Nu s-au observat efecte adverse asupra fertilității la expuneri de aproximativ 603 (bărbați) și 776 (femei) de mai multe ori MRHD. Dozele mai mari care au provocat toxicitate maternă au crescut, de asemenea, resorbțiile fetale (aproximativ 2069 și 6138 ori mai mari decât MRHD). Efecte suplimentare asupra ciclului estros, fertilității, ovulației și implantării au fost observate la aproximativ 6138 ori mai mult decât MRHD.
Toxicologia animalelor
Saxagliptin a produs modificări adverse ale pielii la extremitățile maimuțelor cynomolgus (scorburi și / sau ulcerații ale cozii, cifre, scrot și / sau nas). Leziunile cutanate au fost reversibile de 20 de ori mai mult decât MRHD, dar în unele cazuri au fost ireversibile și necrotizante la expuneri mai mari. Nu au fost observate modificări adverse ale pielii la expuneri similare cu (de la 1 la 3 ori) la MRHD de 5 mg. Corelațiile clinice cu leziunile pielii la maimuțe nu au fost observate în studiile clinice ale saxagliptinei la om.
top
Studii clinice
Onglyza a fost studiat ca monoterapie și în combinație cu metformin, glicuridă și tiazolidinione (pioglitazonă și rosiglitazonă). Onglyza nu a fost studiat în asociere cu insulina.
Un număr de 4148 de pacienți cu diabet zaharat de tip 2 au fost randomizați în șase studii clinice controlate dublu orb, efectuate pentru a evalua siguranța și eficacitatea glicemică a Onglyza. Un total de 3021 de pacienți din aceste studii au fost tratați cu Onglyza. În aceste studii, vârsta medie a fost de 54 de ani, iar 71% dintre pacienți erau caucazieni, 16% erau asiatici, 4% erau negri și 9% din alte grupuri rasiale. Un număr suplimentar de 423 de pacienți, inclusiv 315 care au primit Onglyza, au participat la un studiu controlat cu placebo, care variază în doză, de 6 până la 12 săptămâni.
În aceste șase studii dublu orb, Onglyza a fost evaluat la doze de 2,5 mg și 5 mg o dată pe zi. Trei dintre aceste studii au evaluat, de asemenea, o doză de saxagliptin de 10 mg pe zi. Doza zilnică de 10 mg de saxagliptin nu a furnizat o eficacitate mai mare decât doza zilnică de 5 mg. Tratamentul cu Onglyza la toate dozele a produs îmbunătățiri semnificative din punct de vedere clinic și statistic semnificative ale hemoglobinei A1c (A1C), glucoză plasmatică cu post (FPG) și glucoză postprandială de 2 ore (PPG) după un test standard de toleranță orală la glucoză (OGTT), comparativ cu Control. Au fost observate reduceri ale A1C în subgrupuri, inclusiv sex, vârstă, rasă și IMC de bază.
Onglyza nu a fost asociat cu modificări semnificative de la nivelul inițial al greutății corporale sau a lipidelor serice în post, comparativ cu placebo.
Monoterapie
Un număr total de 766 de pacienți cu diabet zaharat de tip 2 au controlat în mod inadecvat dieta și exercițiile fizice (A1C - 7% până la 10% 10) a participat la două studii de 24 de săptămâni, dublu-orb, controlate cu placebo, care au evaluat eficacitatea și siguranța Onglyza în monoterapie.
În primul studiu, după o dietă single-orb de 2 săptămâni, exerciții fizice și perioada de plumb placebo, 401 de pacienți au fost randomizați la 2,5 mg, 5 mg sau 10 mg de Onglyza sau placebo. Pacienții care nu au reușit să îndeplinească obiective specifice glicemiei în timpul studiului au fost tratați cu terapie de salvare cu metformină, adăugați la placebo sau Onglyza. Eficacitatea a fost evaluată la ultima măsurare înainte de terapia de salvare pentru pacienții care au nevoie de salvare. Titrarea dozei de Onglyza nu a fost permisă.
Tratamentul cu Onglyza 2,5 mg și 5 mg zilnic a furnizat îmbunătățiri semnificative ale A1C, FPG și PPG în comparație cu placebo (tabelul 3). Procentul de pacienți care au întrerupt pentru lipsa controlului glicemic sau care au fost salvați pentru întâlnirea prestabilită criteriile glicemice au fost de 16% în grupul de tratament Onglyza 2,5 mg, 20% în grupul de tratament Onglyza 5 mg și 26% în grupul placebo
Tabelul 3: Parametri glicemici din săptămâna 24 într-un studiu controlat cu placebo al Onglyza monoterapiei la pacienții cu diabet de tip 2 *
| Parametru de eficiență | Onglyza 2,5 mg N = 102 |
Onglyza 5 mg N = 106 |
placebo N = 95 |
|---|---|---|---|
| * Intenția de a trata populația folosind ultima observație la studiu sau ultima observație înainte de terapia de salvare cu metformină pentru pacienții care au nevoie de salvare. | |||
| †Cele mai mici pătrate înseamnă ajustate pentru valoarea de bază. | |||
| c valoarea p <0,0001 comparativ cu placebo | |||
| § valoarea p <0,05 comparativ cu placebo | |||
| ¶ Semnificația nu a fost testată pentru PPG de 2 ore pentru doza de Onglyza de 2,5 mg. | |||
| Hemoglobina A1C (%) | N = 100 | N = 103 | N = 92 |
| Linie de bază (medie) | 7.9 | 8.0 | 7.9 |
| Modificarea de la linia de bază (media ajustată†) | −0.4 | −0.5 | +0.2 |
| Diferența față de placebo (media ajustată†) | −0.6c | −0.6c | |
| 95% Interval de încredere | (−0.9, −0.3) | (−0.9, −0.4) | |
| Procentul pacienților cu A1C <7% | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Glucoză cu plasmă de post (mg / dL) | N = 101 | N = 105 | N = 92 |
| Linie de bază (medie) | 178 | 171 | 172 |
| Modificarea de la linia de bază (media ajustată†) | −15 | −9 | +6 |
| Diferența față de placebo (media ajustată†) | −21 § | −15 § | |
| 95% Interval de încredere | (−31, −10) | (−25, −4) | |
| Glucoză postprandială de 2 ore (mg / dL) | N = 78 | N = 84 | N = 71 |
| Linie de bază (medie) | 279 | 278 | 283 |
| Modificarea de la linia de bază (media ajustată†) | −45 | −43 | −6 |
| Diferența față de placebo (media ajustată†) | −39 ¶ | −37 § | |
| 95% Interval de încredere | (−61, −16) | (−59, −15) |
Un al doilea studiu de monoterapie de 24 de săptămâni a fost realizat pentru a evalua o serie de scheme de dozare pentru Onglyza. Pacienții naivi de tratament cu diabet zaharat controlat inadecvat (A1C - 7% până la 10%) au suferit o dietă de 2 săptămâni, oarbă, exerciții fizice și perioada de plumb placebo. Un număr total de 365 de pacienți au fost randomizați la 2,5 mg în fiecare dimineață, 5 mg în fiecare dimineață, 2,5 mg cu titrare posibilă la 5 mg în fiecare dimineață sau 5 mg în fiecare seară de Onglyza sau placebo. Pacienții care nu au reușit să îndeplinească obiective specifice glicemiei în timpul studiului au fost tratați cu terapie de salvare cu metformină adăugată la placebo sau Onglyza; numărul de pacienți randomizați pe grup de tratament a variat de la 71 la 74.
Tratamentul cu 5 mg Onglyza în fiecare dimineață sau 5 mg în fiecare seară a oferit îmbunătățiri semnificative ale A1C față de placebo (reduceri medii corecte cu placebo de „0,4% și, respectiv, 3,3%). Tratamentul cu Onglyza 2,5 mg în fiecare dimineață a furnizat, de asemenea, o îmbunătățire semnificativă a A1C față de placebo (reducerea medie a corectat cu placebo de 0,0%)
Terapia combinată
Terapia combinată suplimentară cu metformină
Un număr de 743 de pacienți cu diabet de tip 2 au participat la acest studiu de 24 de săptămâni, randomizat, dublu-orb, controlat cu placebo pentru a evalua eficacitatea și siguranța Onglyza în combinație cu metformină la pacienții cu control glicemic inadecvat (A1C - 7 7% și ‰10%) pe metformină singur. Pentru a se califica pentru înscriere, pacienților li sa cerut să fie pe o doză stabilă de metformină (1500-2550 mg pe zi) timp de cel puțin 8 săptămâni.
Pacienții care au îndeplinit criteriile de eligibilitate au fost înscriși într-un singur „orb”, de 2 săptămâni, dietetic și plumb placebo-in perioada în care pacienții au primit metformină în doza de pre-studiu, până la 2500 mg pe zi, pe toată durata studiu. După perioada de plumb, pacienții eligibili au fost randomizați la 2,5 mg, 5 mg sau 10 mg de Onglyza sau placebo, în plus față de doza lor actuală de metformină deschisă. Pacienții care nu au reușit să îndeplinească obiective specifice glicemiei în timpul studiului au fost tratați cu terapie de salvare cu pioglitazonă, adăugată la medicamentele existente. Titlurile de doză de Onglyza și metformină nu au fost permise.
Onglyza 2,5 mg și 5 mg suplimente la meformină au oferit îmbunătățiri semnificative ale A1C, FPG și PPG în comparație cu suplimentul placebo la metformină (Tabelul 4). Modificările medii de la valoarea de bază pentru A1C în timp și la punctul final sunt prezentate în figura 1. Proporția pacienților care au întrerupt pentru lipsa controlului glicemic sau care au fost salvați pentru îndeplinirea criteriilor glicemice prestabilite a fost de 15% în suplimentul Onglyza 2,5 mg la gruparea metformină, 13% în suplimentul Onglyza 5 mg la metformină și 27% în suplimentul cu placebo la metformină grup.
Tabelul 4: Parametri glicemici din săptămâna 24 într-un studiu controlat cu placebo al Onglyza ca terapie combinată suplimentară cu metformină *
| Parametru de eficiență | Onglyza 2,5 mg + Metformina N = 192 |
Onglyza 5 mg + Metformina N = 191 |
placebo + Metformina N = 179 |
|---|---|---|---|
| * Intenția de a trata populația folosind ultima observație la studiu sau ultima observație înainte de terapia de salvare cu pioglitazonă pentru pacienții care au nevoie de salvare. | |||
| †Cele mai mici pătrate înseamnă ajustate pentru valoarea de bază. | |||
| c valoarea p <0,0001 comparativ cu placebo + metformină | |||
| § valoarea p <0,05 comparativ cu placebo + metformin | |||
| Hemoglobina A1C (%) | N = 186 | N = 186 | N = 175 |
| Linie de bază (medie) | 8.1 | 8.1 | 8.1 |
| Modificarea de la linia de bază (media ajustată†) | −0.6 | −0.7 | +0.1 |
| Diferența față de placebo (media ajustată†) | −0.7c | −0.8c | |
| 95% Interval de încredere | (−0.9, −0.5) | (−1.0, −0.6) | |
| Procentul pacienților cu A1C <7% | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Glucoză cu plasmă de post (mg / dL) | N = 188 | N = 187 | N = 176 |
| Linie de bază (medie) | 174 | 179 | 175 |
| Modificarea de la linia de bază (media ajustată†) | −14 | −22 | +1 |
| Diferența față de placebo (media ajustată†) | −16 § | −23 § | |
| 95% Interval de încredere | (−23, −9) | (−30, −16) | |
| Glucoză postprandială de 2 ore (mg / dL) | N = 155 | N = 155 | N = 135 |
| Linie de bază (medie) | 294 | 296 | 295 |
| Modificarea de la linia de bază (media ajustată†) | −62 | −58 | −18 |
| Diferența față de placebo (media ajustată†) | −44 § | −40 § | |
| 95% Interval de încredere | (−60, −27) | (−56, −24) |
Figura 1: Modificarea medie de la valoarea inițială în A1C într-un studiu controlat cu placebo de Onglyza ca terapie combinată suplimentară cu Metformin *
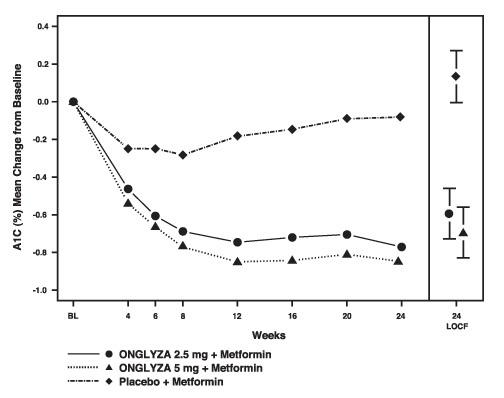
* Include pacienți cu valoarea de bază și valoarea săptămânii 24.
Săptămâna 24 (LOCF) include populația intenționată de tratat folosind ultima observație la studiu înainte de terapia de salvare cu pioglitazonă pentru pacienții care au nevoie de salvare. Modificarea medie de la valoarea de bază este ajustată pentru valoarea de bază.
Terapia combinată suplimentară cu o thiazolidinedione
Un total de 565 de pacienți cu diabet de tip 2 au participat la acest studiu de 24 de săptămâni, randomizat, dublu-orb, controlat cu placebo pentru a evalua eficacitatea și siguranța Onglyza în combinație cu tiazolidinione (TZD) la pacienții cu control glicemic inadecvat (A1C - 7 ¥ 7% până la â10,5%) la TZD singur. Pentru a se califica pentru înscriere, pacienții li s-a cerut o doză stabilă de pioglitazonă (30-45 mg o dată pe zi) sau rosiglitazonă (4 mg o dată pe zi sau 8 mg, o dată pe zi sau în două doze divizate de 4 mg) timp de cel puțin 12 săptămâni.
Pacienții care au îndeplinit criteriile de eligibilitate au fost înscriși într-un singur orb, 2 săptămâni, dietetic și exerciții fizice perioada de plumb placebo în timpul căreia pacienții au primit TZD la doza lor pre-studiu pentru toată durata studiu. După perioada de plumb, pacienții eligibili au fost randomizați la 2,5 mg sau 5 mg de Onglyza sau placebo, în plus față de doza lor actuală de TZD. Pacienții care nu au reușit să îndeplinească obiective specifice glicemiei în timpul studiului au fost tratați cu salvare cu metformină, adăugați la medicamentele de studiu existente. Titrarea dozei de Onglyza sau TZD nu a fost permisă în timpul studiului. O modificare a regimului TZD de la rosiglitazonă la pioglitazonă la doze terapeutice echivalente specificate a fost permisă la discreția investigatorului, dacă se crede că este adecvat din punct de vedere medical.
Onglyza 2,5 mg și 5 mg suplimentar la TZD au oferit îmbunătățiri semnificative ale A1C, FPG și PPG în comparație cu suplimentul placebo la TZD (Tabelul 5). Proporția pacienților care au întrerupt pentru lipsa controlului glicemic sau care au fost salvați pentru îndeplinirea criteriilor glicemice specificate a fost 10% în suplimentul Onglyza 2,5 mg la grupul TZD, 6% pentru suplimentul Onglyza 5 mg la grupul TZD și 10% în suplimentul placebo la TZD grup.
Tabelul 5: Parametrii glicemici din săptămâna 24 într-un studiu controlat cu placebo al Onglyza ca terapie complementară suplimentară cu o tiazolidinionă *
| Parametru de eficiență | Onglyza 2,5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
placebo + TZD N = 184 |
|---|---|---|---|
| * Intenția de a trata populația folosind ultima observație la studiu sau ultima observație înainte de terapia de salvare cu metformină pentru pacienții care au nevoie de salvare. | |||
| †Cele mai mici pătrate înseamnă ajustate pentru valoarea de bază. | |||
| c valoarea p <0,0001 comparativ cu placebo + TZD | |||
| § valoarea p <0,05 comparativ cu placebo + TZD | |||
| Hemoglobina A1C (%) | N = 192 | N = 183 | N = 180 |
| Linie de bază (medie) | 8.3 | 8.4 | 8.2 |
| Modificarea de la linia de bază (media ajustată†) | −0.7 | −0.9 | −0.3 |
| Diferența față de placebo (media ajustată†) | −0.4 § | −0.6c | |
| 95% Interval de încredere | (−0.6, −0.2) | (−0.8, −0.4) | |
| Procentul pacienților cu A1C <7% | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Glucoză cu plasmă de post (mg / dL) | N = 193 | N = 185 | N = 181 |
| Linie de bază (medie) | 163 | 160 | 162 |
| Modificarea de la linia de bază (media ajustată†) | −14 | −17 | −3 |
| Diferența față de placebo (media ajustată†) | −12 § | −15 § | |
| 95% Interval de încredere | (−20, −3) | (−23, −6) | |
| Glucoză postprandială de 2 ore (mg / dL) | N = 156 | N = 134 | N = 127 |
| Linie de bază (medie) | 296 | 303 | 291 |
| Modificarea de la linia de bază (media ajustată†) | −55 | −65 | −15 |
| Diferența față de placebo (media ajustată†) | −40 § | −50 § | |
| 95% Interval de încredere | (−56, −24) | (−66, −34) |
Terapia combinată suplimentară cu gliceridă
Un număr de 768 de pacienți cu diabet de tip 2 au participat la acest studiu de 24 de săptămâni, randomizat, dublu-orb, controlat cu placebo pentru a evalua eficacitatea și siguranța de Onglyza în combinație cu o sulfonilurea (SU) la pacienții cu control glicemic necorespunzător la înscriere (A1C - 7. ¥ 7,5% până la ‰10%) pe o doză submaximală de SU singur. Pentru a se califica pentru înscriere, pacienților li s-a cerut să fie pe o doză submaximală de SU timp de 2 luni sau mai mult. În acest studiu, Onglyza în combinație cu o doză fixă intermediară de SU a fost comparat cu titrarea la o doză mai mare de SU.
Pacienții care au îndeplinit criteriile de eligibilitate au fost înscriși într-o singură orbă, de 4 săptămâni, dietetică și exerciții de plumb, și plasați pe glicurură 7,5 mg o dată pe zi. După perioada inițială, pacienții eligibili cu A1C - 7% până la 10% - 10% au fost randomizați la 2,5 mg sau 5 mg supliment de Onglyza la 7,5 mg glicură sau placebo, plus o doză zilnică totală de 10 mg de gliburidei. Pacienții care au primit placebo au fost eligibili să beneficieze de titru glicurhidric până la o doză zilnică totală de 15 mg. Nu a fost permisă titrarea ridicată a glicuridei la pacienții care au primit Onglyza 2,5 mg sau 5 mg. Glicurida ar putea fi titrată în orice grup de tratament o dată pe parcursul perioadei de studiu de 24 de săptămâni, datorită hipoglicemiei considerate necesare de către investigator. Aproximativ 92% dintre pacienții din grupul placebo plus glicuridă au fost titrați până la o doză totală zilnică totală de 15 mg în primele 4 săptămâni ale perioadei de studiu. Pacienții care nu au reușit să îndeplinească obiective specifice glicemiei în timpul studiului au fost tratați cu salvare cu metformină, adăugați la medicația de studiu existentă. Titrarea dozei de Onglyza nu a fost permisă în timpul studiului.
În combinație cu glicuridă, Onglyza 2,5 mg și 5 mg au furnizat îmbunătățiri semnificative ale A1C, FPG și PPG în comparație cu grupul placebo plus glicuridă titrat (Tabelul 6). Proporția pacienților care au întrerupt pentru lipsa controlului glicemic sau care au fost salvați pentru îndeplinirea criteriilor glicemice specificate a fost de 18% în suplimentul Onglyza 2,5 mg la grupa glicuridă, 17% în suplimentul Onglyza 5 mg la grupa glicuridă și 30% în placebo plus glicuridă titrată grup.
Tabelul 6: Parametri glicemici din săptămâna 24 într-un studiu controlat cu placebo al Onglyza ca terapie suplimentară combinată cu glicuridă *
| Parametru de eficiență | Onglyza 2,5 mg + Glyburida 7,5 mg N = 248 |
Onglyza 5 mg + Glyburida 7,5 mg N = 253 |
placebo + Glicuridă la nivel înalt N = 267 |
|---|---|---|---|
| * Intenția de a trata populația folosind ultima observație la studiu sau ultima observație înainte de terapia de salvare cu metformină pentru pacienții care au nevoie de salvare. | |||
| †Cele mai mici pătrate înseamnă ajustate pentru valoarea de bază. | |||
| c valoare p <0,0001 în comparație cu glicurură titrată placebo + | |||
| § valoarea p <0,05 în comparație cu glicurura titolată cu placebo + | |||
| Hemoglobina A1C (%) | N = 246 | N = 250 | N = 264 |
| Linie de bază (medie) | 8.4 | 8.5 | 8.4 |
| Modificarea de la linia de bază (media ajustată†) | −0.5 | −0.6 | +0.1 |
| Diferență față de glicurură titrată (media ajustată)†) | −0.6c | −0.7c | |
| 95% Interval de încredere | (−0.8, −0.5) | (−0.9, −0.6) | |
| Procentul pacienților cu A1C <7% | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Glucoză cu plasmă de post (mg / dL) | N = 247 | N = 252 | N = 265 |
| Linie de bază (medie) | 170 | 175 | 174 |
| Modificarea de la linia de bază (media ajustată†) | −7 | −10 | +1 |
| Diferență față de glicurură titrată (media ajustată)†) | −8 § | −10 § | |
| 95% Interval de încredere | (−14, −1) | (−17, −4) | |
| Glucoză postprandială de 2 ore (mg / dL) | N = 195 | N = 202 | N = 206 |
| Linie de bază (medie) | 309 | 315 | 323 |
| Modificarea de la linia de bază (media ajustată†) | −31 | −34 | +8 |
| Diferență față de glicurură titrată (media ajustată)†) | −38 § | −42 § | |
| 95% Interval de încredere | (−50, −27) | (−53, −31) |
Administrarea concomitentă cu Metformin la pacienții naivi de tratament
Un total de 1306 pacienți naivi de tratament cu diabet zaharat de tip 2 au participat la acest studiu de 24 de săptămâni, randomizat, dublu-orb, controlat cu placebo la evaluați eficacitatea și siguranța Onglyza administrate împreună cu metformină la pacienții cu control glicemic inadecvat (A1C - 8% până la â12%) la dietă și exerciții fizice singur. Pacienții au fost obligați să fie naivi pentru tratament pentru a fi înscriși în acest studiu.
Pacienții care au îndeplinit criteriile de eligibilitate au fost înrolați într-o singură orbă, de o săptămână, dietetică și cu exerciții de plumb placebo. Pacienții au fost randomizați la unul dintre cele patru brațe de tratament: Onglyza 5 mg + metformin 500 mg, saxagliptin 10 mg + metformin 500 mg, saxagliptin 10 mg + placebo sau metformin 500 mg + placebo. Onglyza a fost dozat o dată pe zi. În cele 3 grupuri de tratament care folosesc metformină, doza de metformină a fost titrată în fiecare săptămână în intervale de 500 mg pe zi, tolerată, până la maximum 2000 mg pe zi pe baza de FPG. Pacienții care nu au reușit să îndeplinească obiective specifice glicemiei în timpul studiilor au fost tratați cu salvare cu pioglitazonă ca terapie suplimentară.
Administrarea concomitentă a Onglyza 5 mg plus metformină a furnizat îmbunătățiri semnificative ale A1C, FPG și PPG în comparație cu placebo plus metformină (Tabelul 7).
Tabelul 7: Parametri glicemici în Săptămâna 24 într-un studiu controlat cu placebo de Onglyza Coadministrarea cu Metformin la pacienții naivi de tratament
| Parametru de eficiență | Onglyza 5 mg + Metformina N = 320 |
placebo + Metformina N = 328 |
|---|---|---|
| * Intenția de a trata populația folosind ultima observație la studiu sau ultima observație înainte de terapia de salvare cu pioglitazonă pentru pacienții care au nevoie de salvare. | ||
| †Cele mai mici pătrate înseamnă ajustate pentru valoarea de bază. | ||
| c valoarea p <0,0001 comparativ cu placebo + metformină | ||
| § valoarea p <0,05 comparativ cu placebo + metformin | ||
| Hemoglobina A1C (%) | N = 306 | N = 313 |
| Linie de bază (medie) | 9.4 | 9.4 |
| Modificarea de la linia de bază (media ajustată†) | −2.5 | −2.0 |
| Diferența față de placebo + metformină (media ajustată†) | −0.5c | |
| 95% Interval de încredere | (−0.7, −0.4) | |
| Procentul pacienților cu A1C <7% | 60% §(185/307) | 41% (129/314) |
| Glucoză cu plasmă de post (mg / dL) | N = 315 | N = 320 |
| Linie de bază (medie) | 199 | 199 |
| Modificarea de la linia de bază (media ajustată†) | −60 | −47 |
| Diferența față de placebo + metformină (media ajustată†) | −13 § | |
| 95% Interval de încredere | (−19, −6) | |
| Glucoză postprandială de 2 ore (mg / dL) | N = 146 | N = 141 |
| Linie de bază (medie) | 340 | 355 |
| Modificarea de la linia de bază (media ajustată†) | −138 | −97 |
| Diferența față de placebo + metformină (media ajustată†) | −41 § | |
| 95% Interval de încredere | (−57, −25) |
top
Cât este furnizat
Tabletele Onglyza ™ (saxagliptin) au marcaje pe ambele părți și sunt disponibile în punctele tari și pachetele enumerate în tabelul 8.
| Comprimat Putere |
Tabletă filmată Culoare / Forma |
Comprimat Marcajele |
Mărimea Pachetului | Codul NDC |
|---|---|---|---|---|
| 5 mg | roz biconvex, rotund |
„5” pe o parte și „4215” pe revers, cu cerneală albastră | Sticle de 30 Sticle de 90 Sticle de 500 Blister de 100 |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | galben pal la galben deschis biconvex, rotund |
„2.5” pe o parte și „4214” pe revers, cu cerneală albastră | Sticle de 30 Sticle de 90 |
0003-4214-11 0003-4214-21 |
Depozitare și manipulare
A se păstra la 20 ° -25 ° C (68 ° -77 ° F); excursii permise la 15 ° -30 ° C (59 ° -86 ° F) [vezi Temperatura camerei controlate USP].
top
Ultima actualizare: 07/09
E.R. Squibb & Sons, L.L.C.
Onglyza informații despre pacienți
Informații detaliate despre semne, simptome, cauze, tratamente ale diabetului
Informațiile din această monografie nu sunt destinate să acopere toate utilizările, indicațiile, precauțiile, interacțiunile medicamentoase sau efectele adverse posibile. Aceste informații sunt generalizate și nu sunt destinate unor sfaturi medicale specifice. Dacă aveți întrebări despre medicamentele pe care le luați sau doriți mai multe informații, consultați medicul, farmacistul sau asistenta medicală.
înapoi la: Căutați toate medicamentele pentru diabet

