Iloperidone (fanapt) Informații complete despre prescriere
Nume de brand: Fanapt
Denumire generică: Iloperidonă
Ghid de prescriere Fanapt (Iloperidone) (PDF)
Cuprins:
Avertisment în cutie
Indicații și utilizare
Dozaj si administrare
Contraindicații
Avertismente și precauții
Reactii adverse
Interacțiunile medicamentoase
Utilizare în populații specifice
Abuzul de droguri și dependența
Supradozaj
Descriere
Farmacologie clinică
Toxicologie nonclinică
Studii clinice
Cât este furnizat
Ghidul pentru medicamente Brintellix
AVERTIZARE: MORTALITĂȚI MĂRURI LA PACIENȚI PRINCIPAȚI CU PSIHOZĂ RELATĂ DE DEMENTIA
Pacienții vârstnici cu psihoză legată de demență tratată cu medicamente antipsihotice prezintă un risc crescut de deces. FANAPT nu este aprobat pentru tratamentul pacienților cu psihoză legată de demență.
Indicații și utilizare
FANAPT® este indicat pentru tratamentul schizofreniei la adulți.
Atunci când decide între tratamentele alternative disponibile pentru această afecțiune, medicul care prescrie medicul ar trebui să ia în considerare constatarea că FANAPT este asociată cu prelungirea intervalului QTc. Prelungirea intervalului QTc este asociată în unele alte medicamente cu capacitatea de a provoca torsade aritmie de tip punctes, o tahicardie ventriculară polimorfă potențial fatală care poate duce la brusc moarte. În multe cazuri, acest lucru ar duce la concluzia că alte medicamente ar trebui să fie încercate mai întâi. Nu se cunoaște dacă FANAPT va cauza torsade de pointes sau va crește rata de moarte subită.
Pacienții trebuie titrați la o doză eficientă de FANAPT. Astfel, controlul simptomelor poate fi întârziat în primele 1 - 2 săptămâni de tratament în comparație cu unele alte medicamente antipsihotice care nu necesită o titrare similară. Prescriptorii ar trebui să fie atenți la această întârziere atunci când selectează un medicament antipsihotic pentru tratamentul schizofreniei.
continua povestea de mai jos
Dozaj si administrare
Doza obișnuită
FANAPT trebuie titrat lent de la o doză inițială mică pentru a evita hipotensiunea ortostatică datorită proprietăților sale de blocare alfa-adrenergice. Doza inițială recomandată pentru comprimatele FANAPT este de 1 mg oral de două ori pe zi. Creșterea dozei pentru a atinge intervalul țintă de 6 -12 mg de două ori pe zi (12_24 mg / zi) se poate face cu ajustări zilnice ale dozei de a nu depăși 2 mg de două ori pe zi (4 mg / zi). Doza maximă recomandată este de 12 mg de două ori pe zi (24 mg / zi). Dozele FANAPT peste 24 mg / zi nu au fost evaluate sistematic în studiile clinice. Eficacitatea a fost demonstrată cu FANAPT într-o doză de 6 până la 12 mg de două ori pe zi. Prescriptorii trebuie să fie atenți la faptul că pacienții trebuie să fie titrați la o doză eficientă de FANAPT. Astfel, controlul simptomelor poate fi întârziat în primele 1 - 2 săptămâni de tratament în comparație cu unele alte medicamente antipsihotice care nu necesită titrare similară. Prescriptorii ar trebui să fie conștienți de faptul că unele efecte adverse asociate cu utilizarea FANAPT sunt legate de doză. FANAPT poate fi administrat fără a ține cont de mese.
Dozare în populații speciale
Ajustarea dozei pentru pacienții care iau FANAPT concomitent cu potențiali inhibitori de CYP2D6: doza de FANAPT trebuie să fie redus la jumătate când se administrează concomitent cu inhibitori puternici de CYP2D6, cum ar fi fluoxetina sau paroxetina. Atunci când inhibitorul CYP2D6 este retras din terapia combinată, doza de FANAPT trebuie apoi crescută până unde a fost înainte.
Ajustarea dozei pentru pacienții care iau FANAPT concomitent cu potențiali inhibitori ai CYP3A4: doza de FANAPT trebuie să fie redus la jumătate atunci când este administrat concomitent cu inhibitori puternici de CYP3A4, cum ar fi ketoconazolul sau claritromicină. Atunci când inhibitorul CYP3A4 este retras din terapia combinată, doza de FANAPT trebuie crescută până la locul anterior.
Ajustarea dozei pentru pacienții care iau FANAPT care sunt metabolizatori săraci de CYP2D6: doza de FANAPT trebuie redusă cu o jumătate pentru metabolizatorii săraci de CYP2D6.
Insuficiență hepatică: Nu este necesară ajustarea dozei la FANAPT la pacienții cu insuficiență hepatică ușoară. Pacienții cu insuficiență hepatică moderată pot necesita reducerea dozei, dacă este indicat clinic. FANAPT nu este recomandat pacienților cu insuficiență hepatică severă.
Tratament de întreținere
Într-un studiu pe termen mai lung, FANAPT a fost eficient în întârzierea timpului de a recidiva la pacienții cu schizofrenie care au fost stabilizați pe FANAPT până la 24 mg / zi. Pacienții trebuie reevaluati periodic pentru a determina necesitatea tratamentului de întreținere.
Reînceperea tratamentului la pacienți anterior a fost întreruptă Deși nu există date care să abordeze în mod specific reînceperea tratament, se recomandă ca programul de titrare de inițiere să fie respectat ori de câte ori pacienții au avut un interval în afara FANAPT mai mult mai mult de 3 zile
top
Forme și puncte forte ale dozajului
Tabletele FANAPT sunt disponibile în următoarele puncte: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg și 12 mg. Tabletele sunt albe, rotunde, plate, tăiate cu margele teșite și identificate cu un logo „„ în relief pe o parte și cu rezistența tabletei „1”, „2”, „4”, „6”, „8”, „10”, sau „12” înfocate pe cealaltă parte.
top
Contraindicații
FANAPT este contraindicat la indivizii cu reacție de hipersensibilitate cunoscută la produs. Au fost raportate anafilaxie, angioedem și alte reacții de hipersensibilitate.
top
AVERTIZĂRI ȘI PRECAUȚII
Mortalitate crescută la pacienții vârstnici cu psihoză legată de demență
Medicamentele antipsihotice cresc riscul de moarte la pacienții vârstnici cu psihoză legată de demență. Analize ale 17 studii de psihoză, controlate cu placebo, legate de demență (durata modală de 10 săptămâni și în mare parte la pacienții care iau atipic medicamente antipsihotice) au evidențiat un risc de deces la pacienții tratați cu medicamente cuprinse între 1,6 și 1,7 ori mai mult decât la pacienții tratați cu placebo. Pe parcursul unui studiu tipic controlat de 10 săptămâni, rata decesului la pacienții tratați cu medicamente a fost de aproximativ 4,5%, comparativ cu o rată de aproximativ 2,6% la pacienții tratați cu placebo.
Deși cauzele decesului au fost variate, majoritatea deceselor păreau a fi fie cardiovasculare (de exemplu, insuficiență cardiacă, moarte subită), fie infecțioase (de exemplu, pneumonie) în natură. FANAPT nu este aprobat pentru tratamentul pacienților cu psihoză legată de demență.
Reacții adverse cerebrovasculare, inclusiv accident vascular cerebral, la pacienții vârstnici cu psihoză legată de demență
În studiile controlate cu placebo la subiecți vârstnici cu demență, pacienții randomizați până la risperidonă, aripiprazolul și olanzapina au avut o incidență mai mare de accident vascular cerebral și atac ischemic tranzitoriu, inclusiv fatal accident vascular cerebral. FANAPT nu este aprobat pentru tratamentul pacienților cu psihoză legată de demență.
Prelungirea QT
Într-un studiu deschis de QTc la pacienți cu schizofrenie sau tulburare schizoafectivă (n = 160), FANAPT a fost asociat cu prelungirea QTc de 9 msec la o doză de iloperidonă de 12 mg de două ori pe zi. Efectul FANAPT asupra intervalului QT a fost mărit prin prezența inhibării metabolice CYP450 2D6 sau 3A4 (paroxetină 20 mg o dată pe zi și, respectiv, ketoconazol 200 mg de două ori pe zi). În condiții de inhibare metabolică atât pentru 2D6 cât și pentru 3A4, FANAPT 12 mg de două ori pe zi a fost asociat cu o creștere medie a QTcF de la valoarea inițială de aproximativ 19 msec.
Nu au fost observate cazuri de torsade de vârfuri sau alte aritmii cardiace severe în timpul programului clinic de pre-comercializare.
Utilizarea FANAPT trebuie evitată în combinație cu alte medicamente despre care se știe că prelungește QTc, incluzând clasa 1A (de exemplu, chinidină, procainamidă) sau clasa III (de exemplu, amiodarona, sotalol) medicamente antiaritmice, medicamente antipsihotice (de exemplu, clorpromazină, tioridazină), antibiotice (de exemplu, gatifloxacină, moxifloxacină) sau orice altă clasă de medicamente cunoscute pentru a prelungi intervalul QTc (de exemplu, pentamidină, acetat de levometadil, metadonă). FANAPT trebuie de asemenea evitat la pacienții cu sindrom QT lung congenital și la pacienții cu antecedente de aritmii cardiace.
Anumite circumstanțe pot crește riscul de torsade de vârf și / sau moarte subită în asociere cu utilizarea de medicamente care prelungesc intervalul QTc, inclusiv (1) bradicardie; (2) hipokalemie sau hipomagnezemie; (3) utilizarea concomitentă a altor medicamente care prelungesc intervalul QTc; și (4) prezența prelungirii congenitale a intervalului QT; (5) infarct miocardic acut recent; și / sau (6) insuficiență cardiacă necompensată.
Se recomandă prudență atunci când se prescrie FANAPT cu medicamente care inhibă metabolismul FANAPT și la pacienții cu activitate redusă a CYP2D6.
Se recomandă ca pacienții să fie luați în considerare pentru tratamentul FANAPT, care prezintă un risc semnificativ tulburările electrolitice au valori de bază ale serului de potasiu și magneziu cu periodic monitorizarea. Hipokalemia (și / sau hipomagneziemia) poate crește riscul prelungirii QT și aritmiei. FANAPT va fi evitat la pacienții cu istoric de boli cardiovasculare semnificative, de exemplu, QT prelungire, infarct miocardic acut recent, insuficiență cardiacă necompensată sau aritmie cardiacă. FANAPT trebuie întrerupt la pacienții cărora li se pare că au măsurători QTc persistente> 500 msec.
Dacă pacienții care iau FANAPT prezintă simptome care ar putea indica apariția aritmiilor cardiace, de ex. amețeli, palpitații sau sincopă, prescriptorul ar trebui să inițieze o evaluare suplimentară, inclusiv cardiace monitorizarea.
Sindromul malign neuroleptic (SNM)
A fost raportat un complex simptomatic potențial fatal, uneori, numit Neuroleptic Malign Syndrome (NMS) în asociere cu administrarea de medicamente antipsihotice, inclusiv FANAPT. Manifestările clinice includ hiperpirexia, rigiditatea musculară, starea mentală alterată (inclusiv semnele catatonice) și dovezi de instabilitate autonomă (puls neregulat sau tensiune arterială, tahicardie, diaforeză și cardiacă) aritmia). Semnele suplimentare pot include creșterea fosfocinazei creatinei, mioglobinurie (rabdomioliză) și insuficiență renală acută. Evaluarea diagnostică a pacienților cu acest sindrom este complicată. Pentru a ajunge la un diagnostic, este important să identificăm cazurile în care include prezentarea clinică atât boli medicale grave, cât și semne și simptome extrapiramidale netratate sau tratate inadecvat (EPS). Alte considerente importante în diagnosticul diferențial includ toxicitatea anticolinergică centrală, accidentul vascular cerebral, febra medicamentoasă și patologia sistemului nervos central primar (SNC).
Managementul acestui sindrom ar trebui să includă: (1) întreruperea imediată a medicamentelor antipsihotice și a altor medicamente care nu sunt esențiale pentru terapia concomitentă (2) tratament simptomatic intens și monitorizare medicală și (3) tratament al oricăror probleme medicale concomitente pentru care sunt disponibile tratamente specifice. Nu există un acord general cu privire la regimurile specifice de tratament farmacologic pentru SNM.
Dacă un pacient necesită un tratament antipsihotic după recuperarea de NMS, ar trebui luată în considerare cu atenție potențialul reintroducere a terapiei medicamentoase. Pacientul trebuie monitorizat cu atenție, deoarece au fost raportate recurențe de SNM.
Diskinezie tardivă
Diskinezia tardivă este un sindrom format din mișcări diskinetice potențial ireversibile, involuntare, care se pot dezvolta la pacienții tratați cu medicamente antipsihotice. Deși prevalența sindromului pare să fie cea mai mare în rândul persoanelor în vârstă, în special la femeile în vârstă, este imposibil se bazează pe estimările de prevalență pentru a prezice, la începutul tratamentului antipsihotic, care este probabil să dezvolte pacienții sindrom. Nu se cunoaște dacă produsele medicamentoase antipsihotice diferă în potențialul lor de a provoca dischinezie tardivă.
Se crede riscul dezvoltării dischineziei tardive și probabilitatea ca acesta să devină ireversibil să crească pe măsură ce durata tratamentului și doza totală cumulată de antipsihotice administrate crește. Cu toate acestea, sindromul se poate dezvolta, deși mult mai rar, după perioade de tratament relativ scurte la doze mici.
Nu este cunoscut un tratament pentru cazurile stabilite de dischinezie tardivă, deși sindromul poate remite, parțial sau complet, dacă tratamentul antipsihotic este retras. Tratamentul antipsihotic în sine poate totuși să suprime (sau să suprime parțial) semnele și simptomele sindromului și, prin urmare, poate masca procesul de bază. Nu se cunoaște efectul pe care îl are supresia simptomatică pe parcursul îndelungat al sindromului.
Având în vedere aceste considerente, FANAPT trebuie prescris într-un mod care este cel mai probabil să minimizeze apariția dischineziei tardive. Tratamentul antipsihotic cronic trebuie rezervat în general pacienților care suferă de o boală cronică la care (1) este cunoscut medicamente antipsihotice și (2) pentru care nu sunt disponibile sau nu sunt disponibile tratamente alternative, la fel de eficiente, dar potențial mai puțin dăunătoare corespunzătoare. La pacienții care necesită tratament cronic, trebuie căutată cea mai mică doză și cea mai scurtă durată a tratamentului care produce un răspuns clinic satisfăcător. Necesitatea tratamentului continuu trebuie reevaluată periodic.
Dacă la FANAPT apar semne și simptome ale dischineziei tardive, trebuie luată în considerare întreruperea medicamentului. Cu toate acestea, unii pacienți pot necesita tratament cu FANAPT în ciuda prezenței sindromului.
Modificări metabolice
Medicamentele antipsihotice atipice au fost asociate cu modificări metabolice care pot crește riscul cardiovascular / cerebrovascular. Aceste modificări metabolice includ hiperglicemia, dislipidemia și creșterea în greutate corporală. În timp ce toate medicamentele antipsihotice atipice s-au dovedit că produc unele modificări metabolice, fiecare medicament din clasă are propriul profil specific de risc.
Hiperglicemie și diabet zaharat
Hiperglucemia, în unele cazuri extremă și asociată cu cetoacidoză sau comă sau moarte hiperosmolară, a fost raportată la pacienții tratați cu antipsihotice atipice, inclusiv FANAPT. Evaluarea relației dintre utilizarea antipsihotică atipică și anomaliile glicemiei este complicată de posibilitatea creșterii risc de fond de diabet zaharat la pacienții cu schizofrenie și incidența crescândă a diabetului zaharat în general populație. Având în vedere aceste confuzii, relația dintre utilizarea antipsihotică atipică și evenimentele adverse legate de hiperglicemie nu este complet înțeleasă. Cu toate acestea, studiile epidemiologice sugerează un risc crescut de reacții adverse legate de hiperglicemie la pacienții tratați cu antipsihotice atipice incluse în aceste studii.
Pacienții cu un diagnostic stabilit de diabet zaharat care sunt inițiați pe antipsihotice atipice trebuie monitorizați în mod regulat pentru agravarea controlului glucozei. Pacienții cu factori de risc pentru diabet zaharat (de exemplu, obezitate, istoric familial de diabet) care încep tratamentul cu antipsihoticele atipice ar trebui să fie supuse testării glicemiei în condiții de repaus la începutul tratamentului și periodic în timpul tratament. Orice pacient tratat cu antipsihotice atipice trebuie monitorizat pentru simptomele hiperglicemiei, inclusiv polidipsie, poliurie, polifagie și slăbiciune. Pacienții care dezvoltă simptome de hiperglicemie în timpul tratamentului cu antipsihotice atipice trebuie să fie supus testării glicemiei în condiții de repaus. În unele cazuri, hiperglicemia s-a rezolvat atunci când antipsihoticul atipic a fost întrerupt; cu toate acestea, unii pacienți au necesitat continuarea tratamentului antidiabetic, în ciuda întreruperii medicamentului suspect.
În tabelul 1 sunt prezentate date dintr-un studiu cu doză fixă de 4 săptămâni la subiecți adulți cu schizofrenie, în care au fost prelevate probe de sânge în condiții de repaus.
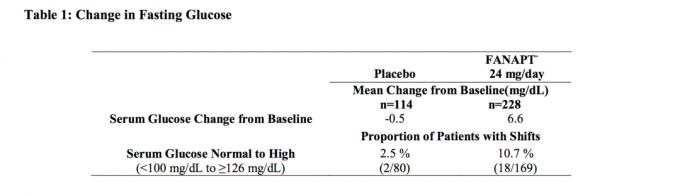
Analizele comune ale datelor privind glucoza din studiile clinice, inclusiv studiile pe termen mai lung, sunt prezentate în tabelul 2.
dislipidemia
Au fost observate modificări nedorite ale lipidelor la pacienții tratați cu antipsihotice atipice.
Datele de la un test cu doză fixă de 4 săptămâni, controlat cu placebo, în care s-au recoltat probe de sânge de post, la subiecții adulți cu schizofrenie sunt prezentate în tabelul 3.

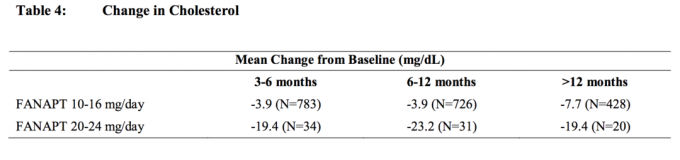
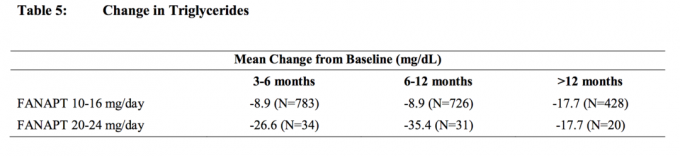
Analizele comune ale colesterolului și ale trigliceridelor din studii clinice, inclusiv studii pe termen mai lung, sunt prezentate în tabelul 4 și în tabelul 5.
Creștere în greutate
Creșterea în greutate a fost observată cu utilizarea antipsihotică atipică. Se recomandă monitorizarea clinică a greutății.
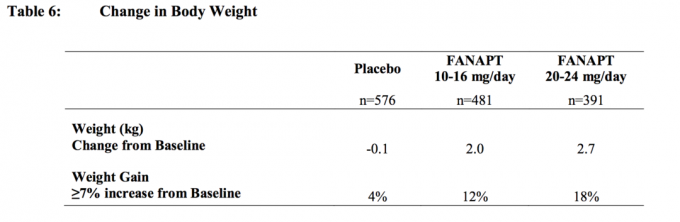
La toate studiile pe termen scurt și lung, media medie generală de la valoarea inițială la final a fost de 2,1 kg.
Modificări ale greutății corporale (kg) și a proporției subiecților cu ≥7% creșterea greutății corporale de la 4 Studii cu doză fixă sau flexibilă, controlată cu placebo, de 4 sau 6 săptămâni, la subiecți adulți sunt prezentate în Tabelul 6.
convulsii
În studiile controlate cu placebo pe termen scurt (4-6 săptămâni), convulsii au apărut la 0,1% (1/1344) dintre pacienții tratați cu FANAPT comparativ cu 0,3% (2/587) la placebo. Ca și în cazul altor antipsihotice, FANAPT trebuie utilizat cu precauție la pacienții cu antecedente de convulsii sau cu afecțiuni care pot reduce pragul de criză. Condițiile care scad pragul de sechestru pot fi mai răspândite la o populație de 65 de ani sau mai mult.
Hipotensiune și sincope ortostatice
FANAPT poate induce hipotensiune ortostatică asociată cu amețeli, tahicardie și sincopă. Aceasta reflectă proprietățile sale antagoniste alfa1-adrenergice. În studiile pe termen scurt controlate cu placebo dublu-orb, unde doza a fost crescută lent, după cum se recomandă mai sus, s-a raportat sincopă la 0,4% (5/1344) dintre pacienții tratați cu FANAPT, comparativ cu 0,2% (1/587) la placebo. Hipotensiunea arterială ortostatică a fost raportată la 5% dintre pacienții administrați cu 20-24 mg / zi, 3% dintre pacienți au primit 10-16 mg / zi și 1% din pacienți li s-au administrat placebo. Se estimează că o titrare mai rapidă va crește rata de hipotensiune arterială și sincopă ortostatică.
FANAPT trebuie utilizat cu precauție la pacienții cu afecțiuni cardiovasculare cunoscute (de exemplu, insuficiență cardiacă, istoric de infarct miocardic, ischemie sau conducere anomalii), boli cerebrovasculare sau afecțiuni care predispun pacientul la hipotensiune (deshidratare, hipovolemie și tratament cu antihipertensiv) medicamente). Monitorizarea semnelor vitale ortostatice trebuie luată în considerare la pacienții vulnerabili la hipotensiune.
Leucopenie, Neutropenie și Agranulocitoză
În studiile clinice și experiența de după comercializare, au fost raportate temporal evenimente de leucopenie / neutropenie legate de agenți antipsihotici. Agranulocitoza (inclusiv cazuri fatale) a fost, de asemenea, raportată.
Factorii de risc posibili pentru leucopenie / neutropenie includ număr preexistent de globule albe din sânge (WBC) și istoricul leucopeniei / neutropeniei induse de medicamente. Pacienții cu un WBC scăzut preexistent sau cu antecedente de leucopenie / neutropenie indusă de medicamente ar trebui să își monitorizeze numărul complet de sânge (CBC) frecvent în primele luni de terapie și ar trebui să întrerupă FANAPT la primul semn al scăderii WBC, în absența altor cauze factori.
Pacienții cu neutropenie trebuie monitorizați cu atenție pentru febră sau alte simptome sau semne de infecție și tratate prompt dacă apar astfel de simptome sau semne. Pacienții cu neutropenie severă (număr absolut de neutrofile <1000 / mm3) trebuie să întrerupă FANAPT și să aibă următorul WBC până la recuperare.
hiperprolactinemia
La fel ca în cazul altor medicamente care antagonizează receptorii dopaminei D2, FANAPT crește nivelul de prolactină.
Hiperprolactinemia poate suprima GnRH hipotalamic, ceea ce duce la reducerea secreției de gonadotropină hipofizară. Acesta, la rândul său, poate inhiba funcția de reproducere prin afectarea gonadalsteroidogenezei atât la pacienții de sex feminin cât și la bărbați. Galactorrea, amenoreea, ginecomastia și impotența au fost raportate cu compuși crescători de prolactină. Hiperprolactinemia de lungă durată, când este asociată cu hipogonadism, poate duce la scăderea densității osoase atât la pacienții de sex feminin, cât și la bărbați.
Experimentele de cultură a țesuturilor indică faptul că aproximativ o treime din cancerele de sân uman sunt dependente de prolactină in vitro, a factor de potențială importanță dacă se ia în considerare prescripția acestor medicamente la un pacient cu sân detectat anterior cancer. Au fost observate modificări proliferative ale glandei mamare și creșteri ale prolactinei serice la șoareci și șobolani tratați cu FANAPT. Nici studiile clinice, nici studiile epidemiologice efectuate până în prezent nu au arătat o asociere între administrarea cronică a acestei clase de medicamente și tumorigeneza la om; probele disponibile sunt considerate prea limitate pentru a fi concludente în acest moment.
Într-un studiu controlat cu placebo pe termen scurt (4 săptămâni), modificarea medie de la valoarea inițială la punctul final în nivelurile plasmatice de prolactină pentru grupul tratat cu FANAPT 24 mg / zi a fost o creștere de 2,6 ng / ml comparativ cu o scădere de 6,3 ng / ml în placebo-grup. În acest studiu, nivelurile crescute de prolactină plasmatică au fost observate la 26% dintre adulții tratați cu FANAPT comparativ cu 12% în grupul placebo. În studiile pe termen scurt, FANAPT a fost asociat cu niveluri modeste de creștere a prolactinei în comparație cu creșteri mai mari de prolactină observate cu unii alți agenți antipsihotici. În analiza colectată din studiile clinice, incluzând studiile pe termen mai lung, la 3210 adulți tratați cu iloperidonă, ginecomastia a fost raportată la 2 subiecți de sex masculin (0,1%) comparativ cu 0% la pacienții tratati cu placebo, iar galactorrea a fost raportată la 8 subiecți de sex feminin (0,2%), comparativ cu 3 subiecți de sex feminin (0,5%) la tratament tratat cu placebo pacienți.
Reglarea temperaturii corpului
Distrugerea capacității organismului de a reduce temperatura corpului central a fost atribuită agenților antipsihotici. Se recomandă îngrijiri adecvate atunci când se prescrie FANAPT pentru pacienții care vor întâmpina afecțiuni care pot contribui la o creștere a corpului de bază temperatura, de exemplu, exercitarea intensă, expunerea la căldură extremă, primirea de medicamente concomitente cu activitate anticolinergică sau dacă este supusă deshidratare.
disfagie
Dismotilitatea și aspirația esofagiană au fost asociate cu consumul de medicamente antipsihotice. Pneumonia de aspirație este o cauză frecventă de morbiditate și mortalitate la pacienții vârstnici. FANAPT și alte medicamente antipsihotice trebuie utilizate cu precauție la pacienții cu risc de pneumonie de aspirație.
Sinucidere
Posibilitatea unei tentative de suicid este inerentă bolilor psihotice, iar supravegherea atentă a pacienților cu risc ridicat ar trebui să însoțească terapia medicamentoasă. Prescripțiile pentru FANAPT trebuie scrise pentru cea mai mică cantitate de tablete, în concordanță cu un bun management al pacientului, pentru a reduce riscul de supradozaj.
priapism
Trei cazuri de priapism au fost raportate în programul FANAPT de pre-comercializare. S-a raportat că medicamentele cu efecte de blocare alfa-adrenergice induc priapism. FANAPT împărtășește această activitate farmacologică. Priapism sever poate necesita intervenție chirurgicală.
Potențial pentru tulburări cognitive și motorii
FANAPT, ca și alte antipsihotice, are potențialul de a afecta judecata, gândirea sau abilitățile motorii. În studiile pe termen scurt, controlate cu placebo, somnolența (inclusiv sedarea) a fost raportată la 11,9% (104/874) pacienți adulți tratați cu FANAPT în doze de 10 mg / zi sau mai mari față de 5,3% (31/587) tratați cu placebo. Pacienții trebuie atenționați cu privire la exploatarea mașinilor periculoase, inclusiv a automobilelor, până când sunt siguri că terapia cu FANAPT nu îi afectează negativ.
top
Reactii adverse
Experiență de studii clinice
Deoarece studiile clinice sunt efectuate în condiții variate, ratele de reacție adversă au fost observate în studiul clinic al unui medicament nu poate fi comparat direct cu ratele din studiile clinice ale unui alt medicament și poate să nu reflecte ratele observate în clinică practică. Informațiile de mai jos sunt derivate dintr-o bază de date a studiilor clinice pentru FANAPT constând din 3229 de pacienți expuși la FANAPT în doze de 10 mg / zi sau mai mari, pentru tratamentul schizofreniei. Dintre aceștia, 999 au primit FANAPT timp de cel puțin 6 luni, 657 fiind expuși la FANAPT timp de cel puțin 12 luni. Toți acești pacienți care au primit FANAPT au participat la studii clinice în doze multiple. Condițiile și durata tratamentului cu FANAPT au variat mult și au inclus (în categorii suprapuse), etichete deschise și faze dublu-orb ale studiilor, internați și ambulatori, studii cu doză fixă și doze flexibile și pe termen scurt și mai lung expunere.
Informațiile prezentate în aceste secțiuni au fost obținute din date colectate din 4 săptămâni controlate cu placebo, 4- sau 6 săptămâni, studii cu doză fixă sau flexibilă la pacienții care au primit FANAPT în doze zilnice într-un interval de 10 până la 24 mg (N = 874).
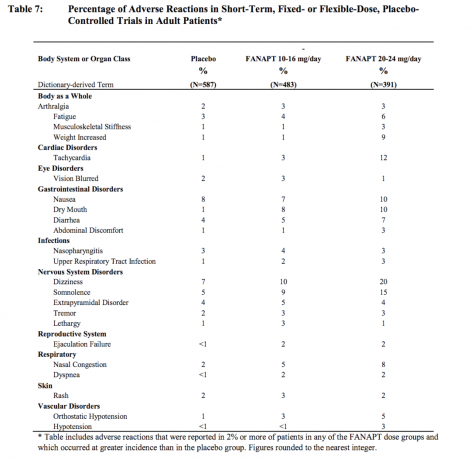
Reacții adverse care au o incidență de 2% sau mai mult în rândul pacienților tratați cu FANAPT și mai frecvent decât placebo
Tabelul 7 enumeră incidențele reunite ale reacțiilor adverse care au fost raportate spontan în patru controlate cu placebo, 4- sau 6 săptămâni, studii cu doză fixă sau flexibilă, care enumeră reacțiile care au apărut la 2% sau mai mulți dintre pacienții tratați cu FANAPT în oricare dintre doze grupuri și pentru care incidența la pacienții tratați cu FANAPT în orice grup de doze a fost mai mare decât incidența la pacienții tratați cu placebo.
Reacții adverse legate de doză în studiile clinice
Pe baza datelor colectate din 4 studii controlate cu placebo, de 4 sau 6 săptămâni, cu doză fixă sau cu doză flexibilă, reacții adverse care au avut loc cu mai mult de 2% incidența la pacienții tratați cu FANAPT și pentru care incidența la pacienții tratați cu FANAPT 20-24 mg / zi a fost de două ori mai mare decât cea a pacienții tratati cu FANAPT 10 -16 mg / zi au fost: disconfort abdominal, amețeli, hipotensiune arterială, rigiditate musculo-scheletică, tahicardie și greutate a crescut.
Reacții adverse frecvente și legate de droguri în studiile clinice
Pe baza datelor colectate de la 4 studii controlate cu placebo, de 4 sau 6 săptămâni, cu doză fixă sau cu doză flexibilă, au apărut următoarele reacții adverse la o incidență de ≥5% la pacienții tratați cu FANAPT și de cel puțin două ori placebo rat e pentru cel puțin 1 doză: amețeli, gură uscată, oboseală, congestie nazală, somnolență, tahicardie, hipotensiune ortostatică și greutate a crescut. Amețelile, tahicardia și creșterea greutății au fost de cel puțin două ori mai frecvente la 20-24 mg / zi decât la 10-16 mg / zi.
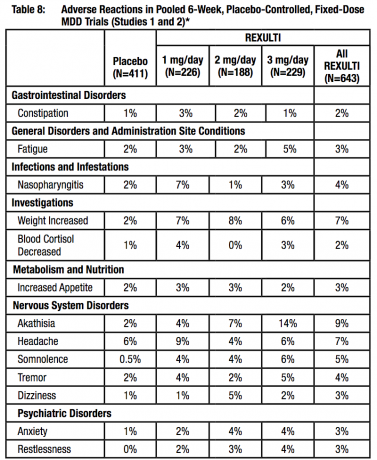
Simptome extrapiramidale (EPS) în studiile clinice
Datele colectate din cele 4 studii cu doză fixă sau flexibilă, controlate cu placebo, de 4 sau 6 săptămâni, au furnizat informații despre EPS. Datele de evenimente adverse colectate din aceste studii au arătat următoarele rate ale evenimentelor adverse legate de EPS, așa cum se arată în tabelul 8.
Reacții adverse asociate cu întreruperea tratamentului în studiile clinice
Pe baza datelor colectate din 4 studii controlate cu placebo, cu 4- sau 6 săptămâni, fixe sau cu doză flexibilă, nu a existat diferență în incidența întreruperii din cauza evenimentelor adverse între FANAPT (5%) și tratat cu placebo (5%) pacienți. Tipurile de evenimente adverse care au dus la întreruperea au fost similare pentru pacienții tratați cu FANAPT și cu placebo.
Diferențe demografice în reacțiile adverse în studiile clinice
O examinare a subgrupurilor de populație din cele 4 săptămâni controlate cu placebo, de 4- sau 6 săptămâni, fixe sau studiile cu doză flexibilă nu au evidențiat nicio dovadă a diferențelor de siguranță pe baza vârstei, sex sau rasă.
Anomalii de teste de laborator în studiile clinice
Nu au existat diferențe între FANAPT și placebo în incidența întreruperii din cauza modificărilor hematologiei, a analizei urinare sau a chimiei serice.
În studiile controlate cu placebo pe termen scurt (4-6 săptămâni), au fost 1,0% (13/1342) pacienți tratați cu iloperidonă cu hematocrit cel puțin o dată sub intervalul normal extins în timpul tratamentului după randomizare, comparativ cu 0,3% (2/585) pe placebo. Intervalul normal extins pentru hematocrit scăzut a fost definit în fiecare dintre aceste studii ca valoare cu 15% sub intervalul normal pentru laboratorul centralizat care a fost utilizat în studiu.
Alte reacții în timpul evaluării pre-comercializare a FANAPT
Următoarea este o listă de termeni MedDRA care reflectă reacții adverse la pacienții tratați cu FANAPT în doze multiple ≥ 4 mg / zi în timpul oricărei faze a unui studiu cu baza de date tratată cu 3210 FANAPT pacienți. Toate reacțiile raportate sunt incluse cu excepția celor deja enumerate în tabelul 7, sau alte părți ale reacțiilor adverse (6), cele considerate în Avertizări și precauții (5), acei termeni de reacție care au fost atât de generali încât să nu fie informați, reacții raportate la mai puțin de 3 pacienți și care nu au fost nici grave, nici amenințarea vieții, reacții care sunt altfel frecvente ca reacții de fond și reacții considerate puțin probabil să fie medicamente legate de.
Reacțiile sunt clasificate în continuare în funcție de clasa de organe a sistemului MedDRA și sunt listate în ordinea scăderii frecvenței în funcție de următoarele definiții: evenimentele adverse frecvente sunt cele care au loc la cel puțin 1/100 de pacienți (doar cele care nu sunt enumerate în tabelul 7 apar în acest sens listare); reacții adverse rare sunt cele care apar la 1/100 la 1/1000 de pacienți; evenimentele rare sunt cele care au loc la mai puțin de 1 000 de pacienți.
Tulburări de sânge și limfatice: rar - anemie, anemie de deficit de fier; Rare-leucopenia
Tulburări cardiace: Frecvent - palpitații; Rare - aritmie, bloc atrioventricular primul grad, insuficiență cardiacă (inclusiv congestive și acute)
Tulburări ale urechii și ale labirintului: rar -vertigo, acufene
Tulburări endocrine: rareori - hipotiroidism
Tulburări oculare: frecvente - conjunctivită (inclusiv alergice); Frecvente - ochi uscat, blefarită, edem al pleoapelor, umflare a ochilor, opacități lenticulare, cataractă, hiperemie (inclusiv conjunctiv)
Tulburări gastrointestinale: infecțioase - gastrită, hipersecreție salivară, incontinență fecală, ulcerații bucale; Rare - stomatită aftoasă, ulcer duodenal, hernie de hiatus, hiperclorhidrie, ulcerații ale buzelor, esofagită de reflux, stomatită
Tulburări generale și condiții ale locului administrativ: infecțioase - edem (general, apariție, din cauza bolilor cardiace), dificultăți de mers, sete; Rare - hipertermie
Tulburări hepatobiliare: rar - colelitiază
Investigații: Frecvent: scăderea greutății; Frecvent - hemoglobina a scăzut, numărul neutrofilelor a crescut, hematocritul a scăzut
Tulburări de metabolizare și nutriție: rar - apetit crescut, deshidratare, hipokalemie, retenție de lichide
Tulburări musculo-scheletice și conjunctive: frecvente - mialgii, spasme musculare; Rare - torticolis
Tulburări ale sistemului nervos: rar - parestezie, hiperactivitate psihomotorie, neliniște, amnezie, nistagmus; Rare - sindromul picioarelor neliniștite
Tulburări psihice: frecvente - neliniște, agresivitate, amăgire; Frecvent - ostilitate, libido scăzut, paranoia, anorgasmie, stare confuzională, manie, catatonie, schimbări de dispoziție, panică atac, tulburare obsesiv-compulsivă, bulimie nervoasă, delir, polidipsie psihologică, tulburare de control al impulsurilor, majoră depresiune
Tulburări renale și urinare: frecvente - incontinență urinară; Frecvente - disurie, pollahurie, enurezis, nefrolitiază; Rare - retenție urinară, insuficiență renală acută
Tulburări ale sistemului reproductiv și ale sânilor: frecvente - disfuncție erectilă; Infrequen - dureri testiculare, amenoree, dureri de sân; Rare - menstruație neregulată, ginecomastie, menoragie, metrorragie, hemoragie postmenopauză, prostatită.
Tulburări respiratorii, toracice și mediastinale: rare - epistaxis, astm, rinoree, congestie sinusală, uscăciune nazală; Rare - gât uscat, sindrom de apnee în somn, dispnee exercitată
Experiență postmarketing
Următoarele reacții adverse au fost identificate în timpul utilizării FANAPT după aprobare: reacții de ejaculare retrogradă și hipersensibilitate (inclusiv anafilaxia; angioedem; etanșeitatea gâtului; umflarea orofaringelui; umflarea feței, buzelor, gurii și limbii; urticarie; eczemă; și prurit). Deoarece aceste reacții au fost raportate voluntar de la o populație de dimensiuni incerte, nu este posibilă estimarea fiabilă a frecvenței lor sau stabilirea unei relații de cauzalitate cu expunerea la medicamente.
top
Interacțiunile medicamentoase
Având în vedere efectele primare ale SNC ale FANAPT, trebuie utilizată prudență atunci când este luată în asociere cu alte medicamente cu alcool central și alcool. Datorită antagonismului receptorului alfa1-adrenergic, FANAPT are potențialul de a îmbunătăți efectul anumitor agenți antihipertensivi.
Potențial pentru alte medicamente să afecteze FANAPT
Iloperidona nu este un substrat pentru enzimele CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 sau CYP2E1. Acest lucru sugerează că este puțin probabilă o interacțiune a iloperidonei cu inhibitori sau inductori ai acestor enzime, sau alți factori, precum fumatul. Atât CYP3A4 cât și CYP2D6 sunt responsabili pentru metabolismul iloperidonei. Inhibitorii CYP3A4 (de exemplu, ketoconazol) sau CYP2D6 (de exemplu, fluoxetină, paroxetină) pot inhiba eliminarea iloperidonei și pot determina creșterea nivelului sanguin.
Ketoconazol: administrarea concomitentă de ketoconazol (200 mg de două ori pe zi timp de 4 zile), un puternic inhibitor al CYP3A4, cu o doză unică de 3 mg de iloperidonă la 19 voluntarii sănătoși, cu vârste cuprinse între 18 și 45 de ani, au mărit cu 57%, 55% și 35% suprafața de sub curba (ASC) a iloperidonei și a metaboliților săi P88 și P95; respectiv. Dozele de iloperidonă trebuie reduse cu aproximativ o jumătate atunci când sunt administrate cu ketoconazol sau cu alți inhibitori puternici ai CYP3A4 (de exemplu, itraconazol). Inhibitori mai slabi (de exemplu, eritromicină, suc de grapefruit) nu au fost studiați. Atunci când inhibitorul CYP3A4 este retras din terapia combinată, doza de iloperidonă trebuie returnată la nivelul anterior.
Fluoxetină: administrarea concomitentă de fluoxetină (20 mg de două ori pe zi timp de 21 de zile), un puternic inhibitor al CYP2D6, cu o singură doză de 3 mg de iloperidonă la 23 de voluntari sănătoși, cu vârste cuprinse între 29 și 44 de ani, care au fost clasificați ca metabolizatori extinși CYP2D6, au crescut ASC a iloperidonei și metabolitului său P88, cu aproximativ 2 - 3 ori, și au scăzut ASC a metabolitului său P95 cu o jumatate. Dozele de iloperidonă trebuie reduse la jumătate atunci când sunt administrate cu fluoxetină. Atunci când fluoxetina este retrasă din terapia combinată, doza de iloperidonă trebuie returnată la nivelul anterior. Se estimează că alți inhibitori puternici ai CYP2D6 vor avea efecte similare și ar avea nevoie de reduceri adecvate ale dozei. Atunci când inhibitorul CYP2D6 este retras din terapia combinată, doza de iloperidonă ar putea fi apoi crescută la nivelul anterior.
Paroxetină: administrarea în comun a paroxetinei (20 mg / zi timp de 5-8 zile), un puternic inhibitor al CYP2D6, cu doze multiple de iloperidonă (8 sau 12 mg de două ori pe zi) la pacienții cu schizofrenie cu vârste cuprinse între 18 și 65 de ani au dus la o concentrație crescută medie a nivelului de vârf iloperidona și metabolitul său P88, cu aproximativ 1,6 ori, și a scăzut concentrațiile medii ale stării de echilibru ale metabolitului său P95 cu o jumatate. Dozele de iloperidonă trebuie reduse la jumătate atunci când sunt administrate cu paroxetină. Atunci când paroxetina este retrasă din terapia combinată, doza de iloperidonă trebuie returnată la nivelul anterior. Se estimează că alți inhibitori puternici ai CYP2D6 vor avea efecte similare și ar avea nevoie de reduceri adecvate ale dozei. Atunci când inhibitorul CYP2D6 este retras din terapia combinată, doza de iloperidonă ar putea fi apoi crescută la nivelurile anterioare.
Paroxetină și Ketoconazol: administrarea concomitentă a paroxetinei (20 mg o dată pe zi timp de 10 zile), a unui inhibitor CYP2D6 și a ketoconazolului (200 mg de două ori pe zi), cu doze multiple de iloperidonă (8 sau 12 mg de două ori pe zi) la pacienții cu schizofrenie cu vârste cuprinse între 18 și 65 de ani, au dus la un 1,4 creșterea de mai multe ori a concentrațiilor de iloperidonă la starea de echilibru și a metabolitului său P88 și o scădere de 1,4 ori a P95 în prezența paroxetina. Deci, administrarea de iloperidonă cu inhibitori ai ambelor căi metabolice nu a adăugat efectul niciunui inhibitor administrat singur. Prin urmare, dozele de iloperidonă trebuie reduse cu aproximativ o jumătate dacă sunt administrate concomitent atât cu un inhibitor al CYP2D6, cât și cu CYP3A4.
Potențial pentru FANAPT să afecteze alte medicamente
Studiile in vitro la microsomii hepatici umani au arătat că iloperidona nu inhibă substanțial metabolismul medicamente metabolizate de următoarele izozimele citocromului P450: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 sau CYP2E1. Mai mult, studiile in vitro la microsomii hepatici umani au arătat că iloperidona nu are inducerea enzimei proprietăți, în special pentru următoarele izozimele citocromului P450: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 și CYP3A5.
Dextrometorfan: Un studiu efectuat la voluntari sănătoși a arătat că modificările farmacocineticii dextrometorfanului (doză de 80 mg) atunci când o doză de 3 mg iloperidona a fost administrată concomitent a dus la o creștere de 17% a expunerii totale și la o creștere de 26% a concentrațiilor plasmatice maxime C max de dextrometorfan. Astfel, este puțin probabilă o interacțiune între iloperidonă și alte substraturi CYP2D6.
Fluoxetină: O singură doză de 3 mg de iloperidonă nu a avut niciun efect asupra farmacocineticii fluoxetinei (20 mg de două ori pe zi).
Midazolam (un substrat sensibil CYP 3A4): Un studiu la pacienții cu schizofrenie a arătat o creștere mai mică de 50% în totalul midazolamului expunere la starea de echilibru a iloperidonei (14 zile de administrare orală până la 10 mg iloperidonă de două ori pe zi) și niciun efect asupra midazolam C max. Astfel, este puțin probabilă o interacțiune între iloperidonă și alte substraturi CYP3A4.
Medicamente care prelungesc intervalul QT FANAPT nu trebuie utilizate cu alte medicamente care prelungesc intervalul QT.
top
Folosiți în populații specifice
Registrul expunerii sarcinii
Există un registru de expunere la sarcină care monitorizează rezultatele sarcinii la femeile expuse la FANAPT în timpul sarcinii. Pentru mai multe informații, contactați Registrul Național al Sarcinii pentru Antipsihoticele Atipice la 1-866-961-2388 sau vizitați http://womensmentalhealth.org/clinical-and -cercetare-programe / pregnancyregistry /.
Rezumatul riscului
Nou-născuții ale căror mame sunt expuse la medicamente antipsihotice, inclusiv FANAPT, în timpul celui de-al treilea trimestru de sarcină prezintă risc de apariție a simptomelor extrapiramidale și / sau de retragere după naștere. Datele disponibile limitate cu FANAPT la femeile gravide nu sunt suficiente pentru a informa riscul asociat medicamentului pentru defecte majore la naștere și avort. Iloperidona nu a fost teratogenă atunci când a fost administrată oral la șobolani gravide în timpul organogenezei, în doze de până la 26 de ori mai mare decât doza umană recomandată de 24 mg / zi, pe bază de mg / m2. Cu toate acestea, a prelungit durata sarcinii și a nașterii, a crescut nașterile născute, decesele intrauterine timpurii, a crescut incidența întârzierilor de dezvoltare și a scăzut supraviețuirea post-partum. Iloperidona nu a fost teratogenă atunci când a fost administrată oral la iepurii gravide în timpul organogenezei, în doze de până la 20 de ori de MRHD pe mg / m2. Cu toate acestea, a crescut decesele intrauterine precoce și a scăzut viabilitatea fetală la termen la cea mai mare doză, care a fost, de asemenea, o doză toxică maternă.
Nu se cunoaște riscul de fond al defectelor majore de naștere și al avortului la populația indicată. În populația generală a Statelor Unite, riscul de antecedente estimat de defecte majore la naștere și avort spontan la sarcinile recunoscute clinic este de 2-4%, respectiv 15-20%.
Considerații clinice
Reacții adverse fetale / neonatale
Simptome extrapiramidale și / sau de retragere, inclusiv agitație, hipertonie, hipotonie, tremor, somnolență, suferință respiratorie și tulburarea de hrănire a fost raportată la nou-născuți ale căror mame au fost expuse la medicamente antipsihotice în al treilea trimestru al sarcinii. Aceste simptome au variat ca severitate. Unii nou-născuți s-au recuperat în câteva ore sau zile fără tratament specific; alții au necesitat spitalizare prelungită. Monitorizați nou-născuții pentru simptome extrapiramidale și / sau de retragere și gestionați în mod corespunzător simptomele.
Date
Date despre animale
Într-un studiu de dezvoltare embrio-fetală, șobolanii gravide au primit 4, 16 sau 64 mg / kg / zi (1,6, 6,5 și de 26 de ori doza maximă recomandată la om (MRHD) de 24 mg / zi pe bază de mg / m2) de iloperidonă pe parcursul perioadei de organogeneza. Cea mai mare doză a cauzat creșterea deceselor intrauterine timpurii, scăderea greutății fetale și a lungimii, scăderea osificării scheletului fetal și o incidență crescută a anomaliilor scheletului fetal minore și variații; această doză a determinat, de asemenea, scăderea consumului de hrană maternă și creșterea în greutate.
Într-un studiu de dezvoltare embrio-fetală, iepurii gravide au primit 4, 10 sau 25 mg / kg / zi (3, 8 și de 20 de ori MRHD pe o bază de mg / m2) de iloperidonă în perioada organogenezei. Cea mai mare doză a cauzat creșterea deceselor intrauterine timpurii și scăderea viabilității fetale la termen; această doză a provocat și toxicitate maternă.
În studiile suplimentare la care șobolanii li s-a administrat iloperidonă în doze similare celor de mai sus, începând fie de la preconcepție, fie de la ziua 17 de gestație și continuarea prin înțărcare, efectele adverse de reproducere au inclus sarcina prelungită și nașterea crescută rate de naștere mortală, creșterea incidenței variațiilor viscerale fetale, scăderea greutăților fetale și a puilor și scăderea puțului post-partum supravieţuire. Nu au existat efecte medicamentoase asupra dezvoltării neurobehaviorale sau reproductive a puii supraviețuitori. Dozele fără efect au variat de la 4 la 12 mg / kg, cu excepția creșterii ratelor de naștere care au avut loc la cea mai mică doză testată de 4 mg / kg, care este de 1,6 ori mai mare decât MRHD. Toxicitatea maternă a fost observată la dozele mai mari din aceste studii.
Metabolitul iloperidonei P95, care este un metabolit major circulant al iloperidonei la om, dar nu este prezent la cantități semnificative la șobolani, a fost administrat șobolanilor gravide în perioada organogenezei în doze orale de 20, 80 sau 200 mg kg / zi. Nu s-au observat efecte teratogene. Osificarea scheletică întârziată a apărut la toate dozele. Nu a fost produsă o toxicitate maternă semnificativă. Nivelurile plasmatice de P95 (ASC) la cea mai mare doză testată au fost de 2 ori cele la om care au primit MRHD de iloperidonă.
lactație
Rezumatul riscului
Nu există informații cu privire la prezența iloperidonei sau a metaboliților acesteia în laptele uman efectele iloperidonei asupra unui copil alăptat și nici efectele iloperidonei asupra laptelui uman producție. Iloperidona este prezentă în laptele de șobolan. Din cauza potențialului de reacții adverse grave la sugarii alăptați, sfătuiți o femeie să nu alăpteze în timpul tratamentului cu FANAPT.
Date Transferul radioactivității în laptele șobolanilor alăptați a fost investigat după o doză unică de [14C] iloperidonă la 5 mg / kg. Concentrația de radioactivitate în lapte la 4 ore după doză a fost de aproape 10 ori mai mare decât cea din plasmă în același timp. Cu toate acestea, la 24 de ore de la dozare, concentrațiile de radioactivitate în lapte au scăzut la valori ușor mai mici decât plasma. Profilul metabolic în lapte a fost similar calitativ cu cel din plasmă.
Utilizare pediatrică Nu au fost stabilite siguranța și eficacitatea la pacienții pediatri și adolescenți.
Utilizare geriatrică
Studiile clinice ale FANAPT în tratamentul schizofreniei nu au inclus un număr suficient de pacienți cu vârsta de 65 de ani și peste pentru a determina dacă răspund sau nu diferit față de adultul mai tânăr pacienți. Dintre cei 3210 pacienți tratati cu FANAPT în studiile de pre-comercializare, 25 (0,5%) aveau ≥65 ani și nu existau pacienți ≥75 ani.
Pacienții vârstnici cu psihoză legată de demență tratată cu FANAPT prezintă un risc crescut de deces în comparație cu placebo. FANAPT nu este aprobat pentru tratamentul pacienților cu psihoză legată de demență.
Insuficiență renală
Deoarece FANAPT este metabolizat puternic, cu mai puțin de 1% din medicament excretat neschimbat, insuficiența renală singură este puțin probabil să aibă un impact semnificativ asupra farmacocineticii FANAPT. Insuficiența renală (clearance al creatininei <30 ml / min) a avut un efect minim asupra Cmax de iloperidonă (administrată într-o singură doză de 3 mg) și metabolitele sale P88 și P95 în oricare dintre cele 3 analitice măsurate. AUC0 - ∞ a crescut cu 24%, a scăzut cu 6% și a crescut cu 52% pentru iloperidonă, respectiv P88 și P95, la subiecții cu insuficiență renală.
Deficiență hepatică
Nu este necesară ajustarea dozei la FANAPT la pacienții cu insuficiență hepatică ușoară. Pacienții cu insuficiență hepatică moderată pot necesita reducerea dozei. FANAPT nu este recomandat pacienților cu insuficiență hepatică severă.
La subiecții adulți cu insuficiență hepatică ușoară, nu a fost observată o diferență relevantă în farmacocinetica iloperidonei, P88 sau P95 (total sau nelimitat) comparativ cu controalele adulte sănătoase. La subiecții cu insuficiență hepatică moderată, o expunere liberă mai mare (de 2 ori) și mai variabilă la metaboliții activi P88 a fost observat comparativ cu controalele sănătoase, în timp ce expunerea la iloperidonă și P95 a fost în general similară (mai puțin de 50% modificare comparativ cu Control). Deoarece nu a fost efectuat un studiu la subiecți cu insuficiență hepatică severă, FANAPT nu este recomandat pacienților cu insuficiență hepatică severă.
Statutul de fumat
Bazat pe studii in vitro care utilizează enzime hepatice umane, FANAPT nu este un substrat pentru CYP1A2; Prin urmare, fumatul nu ar trebui să aibă un efect asupra farmacocineticii FANAPT.
graviditate
top
Abuzul de droguri și dependența
Substanta controlata
FANAPT nu este o substanță controlată.
Abuz
FANAPT nu a fost studiat sistematic la animale sau oameni pentru potențialul său de abuz, toleranță sau dependență fizică. În timp ce studiile clinice nu au evidențiat nicio tendință de comportament în căutarea medicamentelor, aceste observații nu au fost sistematice și nu este posibil să prezice pe baza acestei experiențe măsura în care un medicament activ SNC, FANAPT, va fi folosit greșit, deviat și / sau abuzat o dată comercializate. În consecință, pacienții trebuie evaluați cu atenție pentru un istoric de abuz de droguri, iar astfel de pacienți ar trebui să fie observată îndeaproape pentru semne de abuz sau abuz de FANAPT (de exemplu, dezvoltarea toleranței, creșterea dozei, căutarea medicamentelor) comportament).
top
Supradozarea
Experiență umană
În studiile de pre-comercializare care au implicat peste 3210 pacienți, a fost supradozaj accidental sau intenționat de FANAPT documentate la 8 pacienți cuprinse între 48 mg și 576 mg luate simultan și 292 mg administrate pe parcursul a 3 zile perioadă. Nu au fost raportate victime din aceste cazuri. Cea mai mare ingestie unică de FANAPT confirmată a fost de 576 mg; nu au fost observate efecte fizice adverse la acest pacient. Următoarea cea mai mare ingestie confirmată de FANAPT a fost de 438 mg pe o perioadă de 4 zile; Au fost raportate simptome extrapiramidale și un interval QTc de 507 msec pentru acest pacient fără sechele cardiace. Acest pacient a reluat tratamentul FANAPT pentru încă 11 luni.
În general, semnele și simptomele raportate au fost cele rezultate dintr-o exagerare a efectelor farmacologice cunoscute (de exemplu, somnolență și sedare, tahicardie și hipotensiune) a FANAPT.
Managementul supradozajului
Nu există un antidot specific pentru FANAPT. Prin urmare, ar trebui instituite măsuri de sprijin adecvate. În caz de supradozaj acut, medicul trebuie să stabilească și să mențină o cale aeriană și să asigure oxigenarea și ventilația adecvată. Spălarea gastrică (după intubație, dacă pacientul este inconștient) și administrarea cărbunelui activat împreună cu un laxativ. Posibilitatea obținerii, convulsiilor sau reacției distonice a capului și gâtului în urma supradozajului poate crea un risc de aspirație cu emezie indusă. Monitorizarea cardiovasculară trebuie să înceapă imediat și ar trebui să includă monitorizarea continuă a ECG pentru a detecta aritmii posibile. Dacă se administrează terapie antiaritmică, nu trebuie utilizate disopiramidă, procainamidă și chinidină, deoarece acestea pot avea efecte de prelungire a QT, care ar putea fi aditive la cele ale FANAPT. În mod similar, este rezonabil să ne așteptăm ca proprietățile de blocare alfa a bretilului să fie aditive la cele ale FANAPT, ceea ce duce la hipotensiune arterială problematică. Hipotensiunea și colapsul circulator trebuie tratate cu măsuri adecvate, cum ar fi fluide intravenoase sau agenți simpatomimetici (epinefrină și dopamină nu trebuie utilizate, deoarece stimularea beta poate agrava hipotensiunea arterială în setarea alfa indusă de FANAPT blocadă). În cazurile de simptome extrapiramidale severe, trebuie să se administreze medicamente anticolinergice. Supravegherea medicală atentă trebuie să continue până la recuperarea pacientului.
top
Descriere
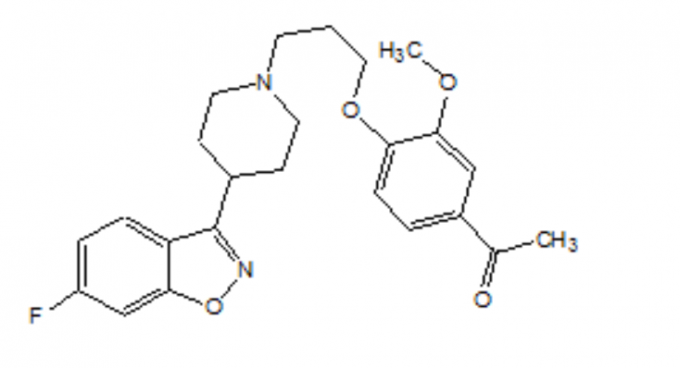
FANAPT este un antipsihotic atipic aparținând clasei chimice a derivaților de piperidinil-benzisoxazol. Numele său chimic este 4 "- [3- [4- (6-Fluoro-1,2- benzisoxazol-3-il) piperidino] propoxi] -3-metoxiacetofenonă. Formula sa moleculară este C24H27FN2O4 și greutatea sa moleculară este 426,48. Formula structurală este:
Iloperidona este o pulbere fină de culoare albă până la alb. Este practic insolubil în apă, foarte ușor solubil în HCl 0,1 N și solubil liber în cloroform, etanol, metanol și acetonitril.
Tabletele FANAPT sunt destinate numai administrării orale. Fiecare rundă, neacoperită
comprimatul conține 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg sau 12 mg de iloperidonă. Ingrediente inactive sunt: lactoză monohidrat, celuloză microcristalină, hidroxipropilmetilceluloză, crospovidona, stearat de magneziu, siliciu coloidal
dioxid și apă purificată (îndepărtată în timpul procesării). Tabletele sunt albe, rotunde, plate, tăiate cu margele teșite și identificate cu un logo „” în relief pe o parte și rezistența tabletei „1”, „2”, „4”, „6”, „8”, „10”, sau „12” înfocate pe cealaltă parte.
top
Farmacologie clinică
Mecanism de acțiune
Mecanismul de acțiune al iloperidonei în schizofrenie nu este cunoscut. Cu toate acestea, eficacitatea iloperidonei poate fi mediată printr-o combinație de antagonism de tip 2 (D2) și serotonină tip 2 (5-HT2).
Iloperidona formează un metabolit activ, P88, care are un profil de legare a receptorului in vitro similar cu medicamentul părinte.
Farmacodinamica
Iloperidona acționează ca un antagonist cu afinitate ridicată (nM) care se leagă la serotonina 5-HT2A dopamina D2 și Receptori D3 și receptori de norepinefrină NEα1 (valorile Ki de 5,6, 6,3, 7,1 și 0,36 nM, respectiv). Iloperidona are o afinitate moderată pentru dopamina D4 și receptorii serotoninei 5-HT6 și 5-HT7 (valorile Ki de 25, 43 și 22, nM respectiv) și afinitate scăzută pentru receptorii serotoninei 5-HT1A, dopamina D1 și histamina H1 (valorile Ki de 168, 216 și 437 nM, respectiv). Iloperidona nu are o afinitate apreciabilă (Ki> 1000 nM) pentru receptorii muscarinici colinergici. Afinitatea metabolitului P88 de iloperidonă este în general egală sau mai mică decât cea a compusului părinte, în timp ce numai metabolitul P95 prezintă afinitate pentru 5-HT2A (valoarea Ki de 3,91) și receptorii NEα1A, NEα1B, NEα1D și NEα2C (valori Ki de 4,7, 2,7, 8,8 și 4,7 nM respectiv).
Farmacocinetica
Timpul de înjumătățire mediu de eliminare observat pentru iloperidonă, P88 și P95 în metabolizatorii extensivi CYP2D6 (EM) sunt 18, 26, respectiv 23 de ore, iar în metabolizatorii săraci (PM) sunt 33, 37 și, respectiv, 31 de ore. Concentrațiile în stare constantă sunt atinse în 3 - 4 zile de la administrare. Acumularea de iloperidonă este previzibilă din farmacocinetica cu o singură doză. Farmacocinetica iloperidonei este mai mare decât proporțională cu doza. Eliminarea iloperidonei se face în principal prin metabolismul hepatic care implică 2 izozimele P450, CYP2D6 și CYP3A4.
Absorbție: Iloperidona este bine absorbită după administrarea comprimatului, cu concentrații plasmatice maxime care apar în 2 până la 4 ore; în timp ce biodisponibilitatea relativă a formulării comprimatului în comparație cu soluția orală este de 96%. Administrarea de iloperidonă cu o masă standard bogată în grăsimi nu a afectat semnificativ Cmax sau ASC de iloperidonă, P88 sau P95, dar Tmax a întârziat cu 1 oră pentru iloperidonă, 2 ore pentru P88 și 6 ore pentru P95. FANAPT poate fi administrat fără a ține cont de mese.
Distribuție: Iloperidona are un clearance aparent (clearance / biodisponibilitate) de 47 până la 102 L / h, cu un volum aparent de distribuție de 1340-2800 L. La concentrații terapeutice, fracția neloperită de iloperidonă în plasmă este de ~ 3% și din fiecare metabolit (P88 și P95) este de ~ 8%.
Metabolism și eliminare: Iloperidona este metabolizată în principal prin 3 căi de biotransformare: reducerea carbonilului, hidroxilarea (mediată de CYP2D6) și O-demetilarea (mediată de CYP3A4). Există 2 metaboliți predominant iloperidonă, P95 și P88. Metabolitul de iloperidonă P95 reprezintă 47,9% din ASC a iloperidonei și a metaboliților săi în plasmă la starea de echilibru pentru metabolizatori extensivi (EM) și 25% pentru metabolizatorii săraci (PM). Metabolitul activ P88 reprezintă 19,5% și 34,0% din expunerea plasmatică totală în EM și, respectiv, PM.
Aproximativ 7% -10% din caucazieni și 3% -8% dintre negrii / afro-americanii nu au capacitatea de a metaboliza CYP2D6 substraturi și sunt clasificate ca metabolizatori săraci (PM), în timp ce restul sunt intermediare, extinse sau ultrarapide metabolizatori. Administrarea concomitentă a FANAPT cu inhibitori puternici cunoscuți ai CYP2D6, cum ar fi fluoxetina, are ca rezultat de 2,3 ori creșterea expunerii plasmatice de iloperidonă și, prin urmare, ar trebui să fie o jumătate din doza de FANAPT administrat.
În mod similar, PM-urile de CYP2D6 au o expunere mai mare la iloperidonă, comparativ cu EM și PM ar trebui să reducă doza lor cu o jumătate. Sunt disponibile teste de laborator pentru identificarea PM CYP2D6.
Cea mai mare parte a materialelor radioactive au fost recuperate în urină (în medie 58,2% și, respectiv, 45,1% în EM și, respectiv, PM), fecalele reprezentând 19,9% (EM) până la 22,1% (PM) din radioactivitatea dozată.
Interacțiunea transportator: Iloperidona și P88 nu sunt substraturi ale P-gp și iloperidona este un inhibitor slab al P-gp.
top
Toxicologie nonclinică
Carcinogeneza, mutageneza, afectarea fertilitatii
Carcinogeneză: Studiile de carcinogenitate de-a lungul vieții au fost efectuate la șoarecii CD-1 și șobolanii Sprague Dawley. Iloperidona a fost administrată oral în doze de 2,5, 5,0 și 10 mg / kg / zi la șoareci CD-1 și 4, 8 și 16 mg / kg / zi la Șobolani Sprague Dawley (0,5, 1,0 și 2,0 ori și 1,6, 3,2 și 6,5 ori, respectiv MRHD de 24 mg / zi pe mg / m2 bază). A existat o incidență crescută de tumori maligne ale glandei mamare la șoarecii de sex feminin tratate cu cea mai mică doză (2,5 mg / kg / zi). Nu au existat creșteri legate de tratament la neoplazie la șobolani.
Potențialul cancerigen al metabolitului de iloperidonă P95, care este un metabolit circulant major al iloperidonei la om, dar nu este prezent la cantități semnificative la șoareci sau șobolani, a fost evaluat într-un studiu de carcinogenitate pe viață la șobolani Wistar la doze orale de 25, 75 și 200 mg / kg / zi la bărbați și 50, 150 și 250 (redus de la 400) mg / kg / zi la femele. Modificările neoplazice legate de medicamente au apărut la bărbați, la nivelul glandei hipofizare (adenom pars distalis) la toate dozele și în pancreas (adenom cu celule insulare) la doză mare. Nivelurile plasmatice de P95 (ASC) la bărbați la dozele testate (25, 75 și 200 mg / kg / zi) au fost de aproximativ 0,4, 3 și, respectiv, de 23 de ori, expunerea umană la P95 la MRHD de iloperidonă.
Mutageneză: Iloperidona a fost negativă în testul Ames și în testele in vivo ale măduvei osoase de șoarece și micronucleu hepatic la șobolan. Iloperidonă a indus aberații cromozomiale în celulele de ovar de hamster chinezesc (CHO) in vitro la concentrații care au provocat, de asemenea, o anumită citotoxicitate.
Metabolitul de iloperidonă P95 a fost negativ în testul Ames, testul de aberație al cromozomilor V79 și un test in micronucleu al măduvei osoase in vivo.
Insuficiența fertilității: Iloperidona a scăzut fertilitatea la 12 și 36 mg / kg într-un studiu în care s-au tratat atât șobolani masculi, cât și femei. Doza fără efect a fost de 4 mg / kg, care este de 1,6 ori mai mare decât MRHD de 24 mg / zi, pe bază de mg / m2.
top
Studii clinice
Eficacitatea FANAPT în tratamentul schizofreniei a fost susținută de 2 placebo și încercări de scurtă durată (4- și 6 săptămâni) controlate activ și un randomizat controlat cu placebo pe termen lung proces de retragere. Toate studiile au înscris pacienții care au îndeplinit criteriile DSM-III / IV pentru schizofrenie.
Au fost utilizate trei instrumente pentru evaluarea semnelor și simptomelor psihiatrice în aceste studii. Scala sindromului pozitiv și negativ (PANSS) și Scala de evaluare psihiatrică scurtă (BPRS) sunt ambele inventare cu mai multe elemente.
de psihopatologie generală utilizată de obicei pentru evaluarea efectelor tratamentului medicamentos în schizofrenie. Evaluarea Clinical Global Impression (CGI) reflectă impresia unui observator priceput, pe deplin familiarizat cu manifestările schizofreniei, despre starea clinică generală a pacientului.
Un studiu de 6 săptămâni, controlat cu placebo (n = 706) a implicat 2 intervale de doze flexibile de FANAPT (12-16 mg / zi sau 20-24 mg / zi) în comparație cu placebo și un control activ (risperidonă). Pentru grupul de 12-16 mg / zi, programul de titrare al FANAPT a fost de 1 mg de două ori pe zi în Zilele 1 și 2, 2 mg de două ori pe zi în Zilele 3 și 4, 4 mg de două ori pe zi în Zilele 5 și 6 și 6 mg de două ori zilnic în ziua a 7-a. Pentru grupul de 20-24 mg / zi, programul de titrare al FANAPT a fost de 1 mg de două ori pe zi în ziua 1, 2 mg de două ori pe zi în ziua 2, 4 mg de două ori pe zi în ziua a 3-a, 6 mg de două ori pe zi în zilele 4 și 5, 8 mg de două ori pe zi în ziua 6, și 10 mg de două ori pe zi în ziua a 7-a. Obiectivul principal a fost modificarea de la valoarea inițială la scorul total al BPRS la sfârșitul tratamentului (ziua 42). Atât 12-16 mg / zi, cât și intervalul de doze de 20-24 mg / zi de FANAPT au fost superioare față de placebo la scorul total BPRS. Medicamentul antipsihotic de control activ a părut a fi superior FANAPT în acest studiu în primele 2 săptămâni, o constatare care poate fi explicată în parte prin titrarea mai rapidă care a fost posibilă pentru asta medicament. La pacienții din acest studiu care au rămas la tratament timp de cel puțin 2 săptămâni, iloperidona a părut să aibă o eficacitate comparabilă cu cea de control activ.
Un studiu de 4 săptămâni, controlat cu placebo (n = 604) a implicat o doză fixă de FANAPT (24 mg / zi) în comparație cu placebo și un control activ (ziprasidona). Programul de titrare pentru acest studiu a fost similar cu cel pentru 6 săptămâni de studiu. Acest studiu a implicat titrarea FANAPT începând cu 1 mg de două ori pe zi în ziua 1 și crescând la 2, 4, 6, 8, 10 și 12 mg de două ori pe zi în zilele 2, 3, 4, 5, 6 și 7. Obiectivul principal a fost modificarea de la valoarea inițială la scorul total PANSS la sfârșitul tratamentului (ziua 28). Doza de FANAPT de 24 mg / zi a fost superioară placebo în scorul total PANSS. FANAPT a părut să aibă o eficacitate similară cu cea a medicamentului de control activ, care a necesitat, de asemenea, o titrare lentă a dozei țintă.
Într-un studiu pe termen mai lung, ambulatorii adulți stabili din punct de vedere clinic (n = 303) care îndeplinesc criteriile DSM-IV pentru schizofrenie care au rămas stabile după 12 săptămâni de Tratamentul cu etichetă deschisă cu doze flexibile de FANAPT (8 mg / zi - 24 mg / zi administrate ca doze de două ori pe zi) au fost randomizate pentru a se administra cu placebo sau pentru a continua doza lor actuală de FANAPT (8 mg / zi - 24 mg / zi administrată de două ori pe zi) pentru observarea unei posibile recidive în timpul recidivei dublu-orb faza de prevenire. Stabilizarea în faza de marcare deschisă a fost definită ca fiind pe o doză stabilită de FANAPT care nu a fost modificată datorită eficacității în cele 4 săptămâni anterioare randomizării, având scorul CGI-Severity ≤4 și scorul total PANSS ≤70, un scor ≤4 la fiecare dintre următoarele elemente PANSS individuale (deliruri P1, dezorganizare conceptuală P2, Comportament halucinant P3, suspiciune / persecuție P6, ostilitate P7 sau necooperare G8) și nici spitalizare sau creștere a nivelului de îngrijire pentru a trata exacerbări. Recidiva sau recidiva iminentă în faza de prevenire a recidivei dublu-orb a fost definită ca oricare dintre următoarele: spitalizare din cauza agravării schizofreniei, creșterea (agravarea) scorului total PANSS ≥30%, CGI-
Punctajul de îmbunătățire ≥6, pacientul a avut un comportament suicid, omucidic sau agresiv sau au nevoie de alte medicamente antipsihotice.

Pe baza analizei interimare, un comitet independent de monitorizare a datelor a decis ca studiul să fie întrerupt din timp din cauza probelor de eficacitate. Pe baza rezultatelor analizei intermediare, care au fost confirmate de setul de date analize finale, au fost tratați pacienții FANAPT a prezentat o perioadă mai lungă statistic semnificativă de recidivă sau recidivă iminentă decât pacienții care au primit placebo. Figura 1 afișează proporția cumulată estimată a pacienților cu recidivă sau recidivă iminentă pe baza setului de date finale.
top
Mod de furnizare / depozitare și manipulare
Tabletele FANAPT sunt albe, rotunde și identificate cu un logo marcat pe o parte și cu rezistența tabletei „1”, „2”, „4”, „6”, „8”, „10” sau „12” în relief pe cealaltă latură. Tabletele sunt furnizate în următoarele puncte tari și configurații ale pachetului:
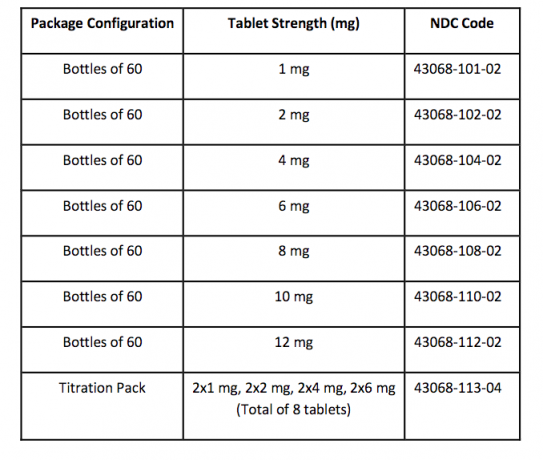
Depozitare
Păstrați comprimatele FANAPT la temperatura camerei controlate, 25 ° C (77 ° F); excursii permise la 15 ° la 30 ° C (59 ° la 86 ° F) [Vezi temperatura camerei controlate USP]. Protejați comprimatele FANAPT de expunerea la lumină și umiditate.
INFORMAȚII PRIVIND CONSILIERUL
Medicii sunt sfătuiți să discute următoarele probleme cu pacienții pentru care prescriu FANAPT:
Prelungirea intervalului QT
Pacienții trebuie sfătuiți să consulte medicul imediat dacă se simt leșinați, își pierd conștiența sau au palpitații cardiace. Pacienții trebuie sfătuiți să nu ia FANAPT cu alte medicamente care determină prelungirea intervalului QT. Pacienții trebuie informați medicii că iau FANAPT înainte de a lua orice medicament nou.
Sindromul malign neuroleptic
Pacienților și îngrijitorilor trebuie să se sfătuiască un complex de simptome potențial fatal uneori menționat ca NMS a fost raportat în asociere cu administrarea de medicamente antipsihotice, inclusiv FANAPT. Semnele și simptomele SNM includ hiperpirexia, rigiditatea musculară, starea mentală alterată și dovezi de autonomie
instabilitate (puls neregulat sau tensiune arterială, tahicardie, diaforeză și ritmie cardiacă).
Modificări metabolice
Pacienții trebuie să fie conștienți de simptomele hiperglicemiei (zahăr ridicat din sânge) și diabet zaharat. Pacienții care sunt diagnosticați cu diabet, cei cu factori de risc pentru diabet sau cei care dezvoltă acestea simptomele în timpul tratamentului trebuie să fie monitorizate glicemia la începutul și periodic în timpul tratament. Pacienții trebuie sfătuiți că s-a produs o creștere în greutate în timpul tratamentului cu FANAPT. Se recomandă monitorizarea clinică a greutății.
Hipotensiune ortostatică
Pacienții trebuie informați cu privire la riscul de hipotensiune arterială ortostatică, în special în momentul începerii tratamentului, relansării tratamentului sau creșterii dozei.
Interferența cu performanțele cognitive și motorii
Deoarece FANAPT poate avea potențialul de a afecta judecata, gândirea sau abilitățile motorii, pacienții ar trebui să fie atenți care operează mașini periculoase, inclusiv automobile, până când sunt siguri că terapia FANAPT nu le afectează negativ.
graviditate
Sfătuiți pacienții că utilizarea Fanapt în al treilea trimestru poate provoca simptome extrapiramidale și / sau retragere la nou-născut. Sfătuiți-i pe pacienți să notifice sarcina cunoscută sau suspectată a furnizorului de servicii medicale.
Registrul sarcinii
Indicați pacienții că există un registru de expunere la sarcină care monitorizează rezultatele sarcinii la femeile expuse la FANAPT în timpul sarcinii
lactație
Sfătuiți femeile să nu alăpteze în timpul tratamentului cu FANAPT.
Medicamente concomitente
Pacienții trebuie sfătuiți să-și informeze medicii în cazul în care iau sau intenționează să ia orice medicamente pe bază de rețetă sau peste medicamente, deoarece există un potențial de interacțiune.
Alcool
Pacienții trebuie sfătuiți să evite alcoolul în timp ce iau FANAPT.
Expunerea la caldura si deshidratarea
Pacienții trebuie sfătuiți cu privire la îngrijiri adecvate pentru a evita supraîncălzirea și deshidratarea.
Distribuit de:
Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 SUA
Vanda și Fanapt® sunt mărci înregistrate ale Vanda Pharmaceuticals Inc. în Statele Unite și în alte țări.
inapoi sus
Ghid de prescriere Fanapt (Iloperidone) (PDF)
Informațiile din această monografie nu sunt destinate să acopere toate utilizările, indicațiile, precauțiile, interacțiunile medicamentoase sau efectele adverse posibile. Aceste informații sunt generalizate și nu sunt destinate unor sfaturi medicale specifice. Dacă aveți întrebări despre medicamentele pe care le luați sau doriți mai multe informații, consultați medicul, farmacistul sau asistenta medicală.
ultima actualizare 07/13
înapoi la: Pagina de start a medicamentelor psihiatrice Farmacologie



