Starlix pentru tratamentul diabetului
Nume de marcă: Starlix
Nume generic: comprimate de nateglinidă
Cuprins:
Descriere
Farmacologie clinică
Studii clinice
Indicații și utilizare
Contraindicații
Măsuri de precauție
Reactii adverse
Supradozarea
Dozaj si administrare
Cât este furnizat
Starlix, nateglinidă, informații complete despre pacient (în engleză simplă)
Descriere
Starlix® (nateglinida) este un agent antidiabetic oral utilizat în administrarea diabetului zaharat de tip 2 [cunoscut și sub denumirea de diabet zaharat non-insulinodependent (NIDDM) sau diabet la început de adult]. Starlix, (-) - N - [(trans-4-izopropilciclohexan) carbonil] -D-fenilalanina, nu are legătură structurală cu secretagogile de insulină sulfonilurea orală.
Formula structurală este după cum se arată
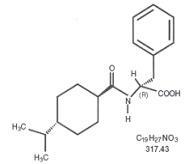
Nateglinida este o pulbere albă cu o greutate moleculară de 317,43. Este solubil liber în metanol, etanol și cloroform, solubil în eter, solubil în mod clar în acetonitril și octanol și practic insolubil în apă. Comprimatele Starlix biconvex conțin nateglinidă 60 mg sau 120 mg pentru administrare orală.
Ingrediente inactive: dioxid de siliciu coloidal, croscarmeloză sodică, hidroxipropil metilceluloză, oxizi de fier (roșu sau galben), lactoză monohidrat, stearat de magneziu, celuloză microcristalină, polietilenglicol, povidonă, talc și titan dioxid de carbon.
top
Farmacologie clinică
Mecanism de acțiune
Nateglinida este un derivat de aminoacizi care scade nivelul glicemiei prin stimularea secreției de insulină din pancreas. Această acțiune depinde de funcționarea celulelor beta din insulele pancreatice. Nateglinida interacționează cu canalul de potasiu (K + ATP) sensibil la ATP pe celulele beta pancreatice. Depolarizarea ulterioară a celulei beta deschide canalul de calciu, producând flux de calciu și secreție de insulină. Măsura eliberării insulinei depinde de glucoză și scade la niveluri scăzute de glucoză. Nateglinida este foarte selectivă a țesuturilor, cu afinitate scăzută pentru inima și mușchiul scheletului.
Farmacocinetica
Absorbţie
După administrarea orală imediat înainte de masă, nateglinida este rapid absorbită, cu concentrații medii plasmatice maxime ale medicamentului (Cmax) care apar în general la 1 oră (Tmax) după administrare. Când se administrează la pacienții cu diabet zaharat de tip 2, se situează în intervalul de doză de 60 mg până la 240 mg de trei ori pe zi pentru unul săptămâna, nateglinida a demonstrat farmacocinetica liniară atât pentru ASC (zonă sub curba concentrației timp / plasmă) cât și Cmax. De asemenea, s-a constatat că Tmax este independent de doză la această populație de pacienți. Biodisponibilitatea absolută este estimată a fi de aproximativ 73%. Când se administrează cu sau după mese, gradul de absorbție a nateglinidelor (ASC) rămâne neafectat. Cu toate acestea, există o întârziere a vitezei de absorbție caracterizată printr-o scădere a Cmax și o întârziere în timp până la concentrația plasmatică maximă (Tmax). Profilele plasmatice sunt caracterizate prin multiple vârfuri de concentrație plasmatică atunci când nateglinida este administrată în condiții de post. Acest efect este diminuat atunci când nateglinida este luată înainte de masă.
distribuire
Pe baza datelor după administrarea intravenoasă (IV) a nateglinidei, se estimează că volumul de distribuție a nateglinidei este la aproximativ 10 litri la subiecți sănătoși. Nateglinida este legată în mare măsură (98%) de proteinele serice, în principal de albumina serică și, într-o măsură mai mică, de glicoproteină acidă ± 1. Mărimea legării proteinelor serice este independentă de concentrația medicamentului în intervalul de testare de 0,1-10 pg / ml.
Metabolism
Nateglinida este metabolizată prin sistemul de oxidază cu funcție mixtă înainte de eliminare. Căile principale ale metabolismului sunt hidroxilarea urmată de conjugarea glucuronidului. Metaboliții majori sunt agenți antidiabetici mai puțin puternici decât nateglinida. Metabolitul minor izoprenului are o putere similară cu cea a compusului parental nateglinidă.
Datele in vitro demonstrează că nateglinida este metabolizată predominant prin izoenzimele citocromului P450 CYP2C9 (70%) și CYP3A4 (30%).
Excreţie
Nateglinida și metaboliții săi sunt eliminați rapid și complet după administrarea orală. În 6 ore de la administrare, aproximativ 75% din 14C-nateglinida administrată a fost recuperată în urină. Optzeci și trei la sută din 14C-nateglinida a fost excretată în urină cu un procent de 10% suplimentar eliminat în materiile fecale. Aproximativ 16% din 14C-nateglinida a fost excretată în urină sub formă de compus parental. În toate studiile efectuate asupra voluntarilor sănătoși și a pacienților cu diabet zaharat de tip 2, concentrațiile plasmatice de nateglinidă au scăzut rapid cu o perioadă de înjumătățire medie de eliminare de aproximativ 1,5 ore. În concordanță cu această perioadă de înjumătățire scurtă de eliminare, nu a existat o acumulare aparentă de nateglinidă după administrarea multiplă de până la 240 mg de trei ori pe zi timp de 7 zile.
Interacțiunile medicamentoase
Studiile de metabolizare a medicamentelor in vitro indică faptul că Starlix este metabolizat predominant prin izozima citocromului P450 CYP2C9 (70%) și într-o măsură mai mică CYP3A4 (30%). Starlix este un potențial inhibitor al izoenzimei CYP2C9 in vivo așa cum este indicat prin capacitatea sa de a inhiba metabolismul in vitro al tolbutamidei. În experimentele in vitro nu a fost detectată inhibarea reacțiilor metabolice CYP3A4.
Glicuridă: într-un studiu randomizat, în doză multiplă, cu încrucișare, au fost pacienți cu diabet zaharat tip 2 administrat 120 mg Starlix de trei ori pe zi înainte de mese timp de 1 zi în combinație cu glicuridă 10 mg zilnic. Nu au existat modificări relevante din punct de vedere clinic în farmacocinetica niciunui agent.
Metformin: Când Starlix 120 mg de trei ori pe zi înainte de masă a fost administrat în asociere cu metformin 500 mg trei ori de zi cu zi la pacienții cu diabet zaharat tip 2, nu au existat modificări relevante din punct de vedere clinic în farmacocinetica agent.
Digoxin: Când Starlix a fost administrat cu 120 mg înainte de mese în combinație cu o singură doză de 1 mg digoxină pentru voluntarii sănătoși, nu au existat modificări clinice relevante în farmacocinetica niciunei agent.
Warfarină: Când subiecții sănătoși li s-a administrat Starlix 120 mg de trei ori pe zi înainte de masă timp de patru zile în combinație cu o singură doză de warfarină 30 mg în ziua 2, nu au existat modificări în farmacocinetica niciunei agent. Timpul de protrombină nu a fost afectat.
Diclofenac: administrarea dozelor de Starlix dimineața și de prânz de 120 mg în combinație cu un singur 75-mg doza de diclofenac la voluntari sănătoși nu a dus la nici o modificare semnificativă la farmacocinetica niciunuia agent.
Populații speciale
Geriatrice: Vârsta nu a influențat proprietățile farmacocinetice ale nateglinidei. Prin urmare, nu sunt necesare ajustări ale dozei pentru pacienții vârstnici.
Sex: Nu s-au observat diferențe semnificative clinic în farmacocinetica nateglinidelor între bărbați și femei. Prin urmare, nu este necesară ajustarea dozei în funcție de sex.
Rasa: Rezultatele unei analize farmacocinetice a populației, inclusiv subiecți de origine caucaziană, neagră și alte etnii sugerează că rasa are o influență mică asupra farmacocineticii nateglinidei.
Insuficiență renală: în comparație cu subiecții potriviți sănătoși, pacienți cu diabet zaharat tip 2 și insuficiență renală moderată până la severă (CrCl 15-50 ml / min) nu pe dializă a afișat aparent similar autorizare, ASC și Cmax. Pacienții cu diabet zaharat tip 2 și insuficiență renală în dializă au prezentat o expunere totală redusă la medicamente. Cu toate acestea, pacienții cu hemodializă au prezentat, de asemenea, reduceri ale legării proteinelor plasmatice în comparație cu voluntarii sănătoși potriviți.
Insuficiență hepatică: Expunerea maximă și totală a nateglinidei la subiecții non-diabetici cu insuficiență hepatică ușoară au crescut cu 30% comparativ cu subiecții sănătoși potriviți. Starlix® (nateglinida) trebuie utilizat cu precauție la pacienții cu boli hepatice cronice. (Vezi PRECAUȚII, Deficiență hepatică.)
Farmacodinamica
Starlix este absorbit rapid și stimulează secreția de insulină pancreatică în termen de 20 de minute de la administrarea orală. Când Starlix este dozat de trei ori pe zi înainte de masă, există o creștere rapidă a insulinei plasmatice, cu niveluri maxime la aproximativ 1 oră după administrare și scăderea până la momentul inițial cu 4 ore după administrare.
Într-un studiu clinic controlat dublu orb, în care a fost administrat Starlix înainte de fiecare din trei mese, nivelurile de glucoză plasmatică au fost determinate pe o durată de 12 ore, în timpul zilei, după 7 săptămâni de tratament. Starlix a fost administrat cu 10 minute înainte de mese. Mesele s-au bazat pe meniuri de menținere a greutății diabetice standard, cu conținutul caloric total bazat pe înălțimea fiecărui subiect. Starlix a produs scăderi semnificative statistic ale postului și glicemiei postprandiale în comparație cu placebo.
top
Studii clinice
Un număr de 3.566 de pacienți au fost randomizați în nouă studii dublu-orb, placebo sau controlate activ, cu durata de 8 până la 24 de săptămâni, pentru a evalua siguranța și eficacitatea Starlix® (nateglinidă). 3.513 pacienți au avut valori de eficacitate peste valoarea inițială. În aceste studii, Starlix a fost administrat cu până la 30 de minute înainte de fiecare din cele trei mese principale pe zi.
Monoterapie Starlix® în comparație cu placebo
Într-un studiu randomizat, dublu-orb, controlat cu placebo, de 24 de săptămâni, pacienții cu diabet zaharat tip 2 cu HbA1C - ‰ ¥ 6,8% numai la dietă au fost randomizate pentru a primi fie Starlix (60 mg sau 120 mg de trei ori pe zi înainte de mese) sau placebo. Basa HbA1C a variat de la 7,9% la 8,1% și 77,8% dintre pacienți nu au fost tratați anterior cu terapie antidiabetică orală. Pacienților tratați anterior cu medicamente antidiabetice li s-a solicitat întreruperea medicamentului timp de cel puțin 2 luni înainte de randomizare. Adăugarea de Starlix înainte de mese a dus la reducerea statistică semnificativă a mediei HbA1C și a glucozei plasmatice medii în condiții de post (FPG) comparativ cu placebo (a se vedea tabelul 1). Reducerile HbA1C și FPG au fost similare pentru pacienții naivi și pentru cei anterior expuși la medicamente antidiabetice.
În acest studiu, a fost raportat un episod de hipoglicemie severă (glucoză plasmatică <36 mg / dL) la un pacient tratat cu Starlix 120 mg de trei ori pe zi înainte de masă. Niciun pacient nu a prezentat hipoglicemie care a necesitat asistență terților. Pacienții tratați cu Starlix au avut o creștere medie semnificativă semnificativ statistic în greutate, comparativ cu placebo (vezi Tabelul 1).
Într-un alt studiu randomizat, dublu-orb, de 24 de săptămâni, activ și controlat cu placebo, pacienții cu diabet de tip 2 au fost randomizați pentru a primi Starlix (120 mg de trei ori zilnic înainte de mese), metformin 500 mg (de trei ori pe zi), o combinație de Starlix 120 mg (de trei ori pe zi înainte de mese) și metformină 500 mg (de trei ori pe zi) sau placebo. Punctul de bază HbA1C a variat de la 8,3% la 8,4%. Cincizeci și șapte la sută dintre pacienți nu au fost tratați anterior cu terapie antidiabetică orală. Monoterapia cu Starlix a dus la reduceri semnificative ale mediei HbA1C și a FPG mediu comparativ cu placebo, care au fost similare cu rezultatele studiului raportat mai sus (a se vedea tabelul 2).
Tabelul 1: Rezultate finale pentru un studiu cu doză fixă de 24 de săptămâni de monoterapie Starlix®
|
placebo |
Starlix® 60 mg de trei ori zilnic inaintea meselor |
Starlix® 120 mg de trei ori zilnic inaintea meselor |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Linie de bază (medie) | 8.0 | 7.9 | 8.1 |
| Schimbare de la linia de bază (medie) | +0.2 | -0.3 | -0.5 |
| Diferența față de placebo (medie) | -0.5 A | -0.7 A | |
| FPG (mg / dL) | N = 172 | N = 171 | N = 169 |
| Linie de bază (medie) | 167.9 | 161.0 | 166.5 |
| Schimbare de la linia de bază (medie) | +9.1 | +0.4 | -4.5 |
| Diferența față de placebo (medie) | -8.7 A | -13.6 A | |
| Greutate (kg) | N = 170 | N = 169 | N = 166 |
| Linie de bază (medie) | 85.8 | 83.7 | 86.3 |
| Schimbare de la linia de bază (medie) | -0.7 | +0.3 | +0.9 |
| Diferența față de placebo (medie) | +1.0 A | +1.6 A |
o valoare p ‰ ¤ 0,004
Monoterapia Starlix® în comparație cu alți agenți antidiabetici orali
Glyburida
Într-un studiu de 24 de săptămâni, dublu-orb, controlat activ, pacienții cu diabet zaharat tip 2 care au fost pe sulfonilurea timp de 3 luni și care au avut un nivel de bază HbA1C - 6,5% au fost randomizate pentru a primi Starlix (60 mg sau 120 mg de trei ori pe zi înainte de mese) sau glicuridă 10 mg o dată zilnic. Pacienții randomizați la Starlix au avut creșteri semnificative ale mediei HbA1C și a mediei FPG la punctul final, comparativ cu pacienții randomizați cu glicuridă.
Metformina
Într-un alt studiu randomizat, dublu-orb, de 24 de săptămâni, activ și controlat cu placebo, pacienții cu diabet de tip 2 au fost randomizați pentru a primi Starlix (120 mg de trei ori zilnic înainte de mese), metformin 500 mg (de trei ori pe zi), o combinație de Starlix 120 mg (de trei ori pe zi înainte de mese) și metformină 500 mg (de trei ori pe zi) sau placebo. Punctul de bază HbA1C a variat de la 8,3% la 8,4%. Cincizeci și șapte la sută dintre pacienți nu au fost tratați anterior cu terapie antidiabetică orală. Reducerile mediei HbA1C și mediei FPG la nivelul final cu monoterapia cu monoterapie au fost semnificativ mai mari decât reducerile acestor variabile cu monoterapia Starlix (vezi Tabelul 2). În raport cu placebo, monoterapia Starlix a fost asociată cu creșteri semnificative ale greutății medii, în timp ce monoterapia cu metformină a fost asociată cu scăderi semnificative ale greutății medii. Dintre subsetul de pacienți care au ajuns la terapia antidiabetică, reducerea mediei HbA1C și a mediei FPG pentru monoterapia cu Starlix au fost similare cu cele pentru monoterapia cu metformină (vezi tabelul 2). Printre subsetul de pacienți tratați anterior cu alți agenți antidiabetici, în principal glicburidă, HbA1C în Starlix grupul de monoterapie a crescut ușor de la nivelul inițial, în timp ce HbA1C a fost redus la grupul de monoterapie cu metformină (vezi tabelul 2).
Terapia combinată Starlix®
Metformina
Într-un alt studiu randomizat, dublu-orb, de 24 de săptămâni, activ și controlat cu placebo, pacienții cu diabet de tip 2 au fost randomizați pentru a primi Starlix (120 mg de trei ori zilnic înainte de mese), metformin 500 mg (de trei ori pe zi), o combinație de Starlix 120 mg (de trei ori pe zi înainte de mese) și metformină 500 mg (de trei ori pe zi) sau placebo. Punctul de bază HbA1C a variat de la 8,3% la 8,4%. Cincizeci și șapte la sută dintre pacienți nu au fost tratați anterior cu terapie antidiabetică orală. Pacienților tratați anterior cu medicamente antidiabetice li s-a cerut să întrerupă medicația timp de cel puțin 2 luni înainte de randomizare. Combinația de Starlix și metformină a dus la reduceri semnificativ mai mari statistic ale HbA1C și FPG, comparativ cu monoterapia cu Starlix sau cu metformină (vezi Tabelul 2). Starlix, singur sau în combinație cu metformin, a redus semnificativ creșterea glicemiei prandiale de la masa prealabilă la 2 ore după masă, comparativ cu placebo și metformină.
În acest studiu, un episod de hipoglicemie severă (glucoză plasmatică - 36 mg / dL) a fost raportat la un pacient care a primit combinație de Starlix și metformină și patru episoade de hipoglicemie severă au fost raportate la un singur pacient în metformină brat de tratament. Niciun pacient nu a prezentat un episod de hipoglicemie care a necesitat asistență terților. În comparație cu placebo, monoterapia Starlix a fost asociată cu o creștere semnificativă semnificativ din punct de vedere statistic, în timp ce nu a fost observată nicio schimbare semnificativă a greutății cu terapia combinată cu Starlix și metformin (vezi Tabelul 2).
Într-un alt studiu de 24 de săptămâni, dublu-orb, controlat cu placebo, pacienții cu diabet zaharat tip 2 cu HbA1C - after ¥ 6,8% după tratamentul cu metformină (1500 ¥ 1500 mg zilnic pentru 1 lună) au fost primiți pentru prima dată într-o perioadă de patru săptămâni de monoterapie cu metformină (2000 mg pe zi) și apoi randomizat pentru a primi Starlix (60 mg sau 120 mg de trei ori pe zi înainte de masă) sau placebo în plus față de metformină. Terapia combinată cu Starlix și metformin a fost asociată cu reduceri semnificativ mai mari din punct de vedere statistic HbA1C în comparație cu monoterapia cu metformin (-0,4% și -0,6% pentru Starlix 60 mg și Starlix 120 mg plus metformină, respectiv).
Tabelul 2: Rezultate finale pentru un studiu de 24 de săptămâni privind terapia Starlix® și combinație cu metformină
|
placebo |
Starlix® 120 mg de trei ori zilnic înainte mese |
Metformina 500 mg de trei ori zilnic |
Starlix® 120 mg inainte de mese plus Metformin * |
|
| HbA1C (%) | ||||
| Toate | N = 160 | N = 171 | N = 172 | N = 162 |
| Linie de bază (medie) | 8.3 | 8.3 | 8.4 | 8.4 |
| Schimbare de la linia de bază (medie) | +0.4 | -0.4 bc | -0.8 c | -1.5 |
| Diferența față de placebo | -0.8 A | -1.2 A | -1.9 A | |
| Nan-ve | N = 98 | N = 99 | N = 98 | N = 81 |
| Linie de bază (medie) | 8.2 | 8.1 | 8.3 | 8.2 |
| Schimbare de la linia de bază (medie) | +0.3 | -0.7 c | -0.8 c | -1.6 |
| Diferența față de placebo | -1.0 A | -1.1 A | -1.9 A | |
| Non-nan-ve | N = 62 | N = 72 | N = 74 | N = 81 |
| Linie de bază (medie) | 8.3 | 8.5 | 8.7 | 8.7 |
| Schimbare de la linia de bază (medie) | +0.6 | +0.004 bc | -0.8 c | -1.4 |
| Diferența față de placebo | -0.6 A | -1.4 A | -2.0 A | |
| FPG (mg / dL) | ||||
| Toate | N = 166 | N = 173 | N = 174 | N = 167 |
| Linie de bază (medie) | 194.0 | 196.5 | 196.0 | 197.7 |
| Schimbare de la linia de bază (medie) | +8.0 | -13.1 bc | -30.0 c | -44.9 |
| Diferența față de placebo | -21.1 A | -38.0 A | -52.9 A | |
| Greutate (kg) | ||||
| Toate | N = 160 | N = 169 | N = 169 | N = 160 |
| Linie de bază (medie) | 85.0 | 85.0 | 86.0 | 87.4 |
| Schimbare de la linia de bază (medie) | -0.4 | +0.9 bc | -0.1 | +0.2 |
| Diferența față de placebo | +1.3 A | +0.3 | +0.6 |
o valoare p ‰ ¤ 0,05 vs. placebo
b p-valoare ‰ ¤ 0,03 vs. metformin
c p-valoare ‰ ¤ 0,05 vs. combinaţie
* Metformin a fost administrat de trei ori pe zi
Rosiglitazonă
A fost efectuat un studiu controlat cu placebo cu 24 de săptămâni, dublu orb, controlat cu placebo la pacienții cu tipul 2 diabetul nu este controlat în mod adecvat după un răspuns terapeutic la rosiglitazonă monoterapie 8 mg zilnic. Adăugarea de Starlix (120 mg de trei ori pe zi cu mesele) a fost asociată cu reduceri semnificativ mai mari statistic ale HbA1C comparativ cu monoterapia cu rosiglitazonă. Diferența a fost de -0,77% la 24 de săptămâni. Modificarea medie a greutății de la valoarea inițială a fost de aproximativ +3 kg pentru pacienții tratați cu Starlix plus rosiglitazonă de aproximativ +1 kg pentru pacienții tratați cu placebo plus rosiglitazonă.
Glyburida
Într-un studiu de 12 săptămâni la pacienții cu diabet zaharat tip 2, controlat în mod inadecvat cu 10 mg glicuridă o dată pe zi, adăugarea de Starlix (60 mg sau 120 mg de trei ori pe zi înainte de masă) nu a produs niciun suplimentar beneficiu.
top
Indicații și utilizare
Starlix® (nateglinida) este indicat ca adjuvant la dietă și exerciții fizice pentru a îmbunătăți controlul glicemic la adulții cu diabet zaharat de tip 2.
top
Contraindicații
Starlix® (nateglinida) este contraindicat la pacienții cu:
1. Hipersensibilitate cunoscută la medicament sau la ingredientele sale inactive.
2. Diabetul de tip 1.
3. Cetoacidoza diabetică. Această afecțiune trebuie tratată cu insulină.
top
Măsuri de precauție
Rezultate macrovasculare: Nu au existat studii clinice care să stabilească dovezi concludente privind reducerea riscului macrovascular cu Starlix sau orice alt medicament antidiabetic.
Hipoglicemie: toate medicamentele care scad glicemia orală care sunt absorbite sistemic sunt capabile să producă hipoglicemie. Frecvența hipoglicemiei este legată de severitatea diabetului, de nivelul de control glicemic și de alte caracteristici ale pacientului. Pacienții geriatri, pacienții subnutriți și cei cu insuficiență suprarenală sau hipofizară sau cu insuficiență renală severă sunt mai susceptibili la efectul de scădere a glucozei din aceste tratamente. Riscul de hipoglicemie poate fi crescut prin efort fizic intens, prin ingestia de alcool, aport caloric insuficient pe o bază acută sau cronică sau combinații cu alte antidiabetice orale agenți. Hipoglicemia poate fi dificil de recunoscut la pacienții cu neuropatie autonomă și / sau la cei care utilizează beta-blocante. Starlix® (nateglinidă) trebuie administrat înainte de mese pentru a reduce riscul de hipoglicemie. Pacienții care sari peste mese ar trebui, de asemenea, să sară doza programată de Starlix pentru a reduce riscul de hipoglicemie.
Insuficiență hepatică: Starlix trebuie utilizat cu precauție la pacienții cu boală hepatică moderată până la severă, deoarece astfel de pacienți nu au fost studiați.
Pierderea controlului glicemic
Pierderea tranzitorie a controlului glicemic poate apărea cu febră, infecție, traume sau intervenții chirurgicale. Insuloterapia poate fi necesară în locul terapiei cu Starlix în astfel de momente. Poate să apară eșecul secundar sau eficacitatea redusă a Starlix într-o perioadă de timp.
Informații pentru pacienți
Pacienții trebuie informați despre riscurile și beneficiile potențiale ale Starlix și despre modurile alternative de terapie. Ar trebui explicate riscurile și managementul hipoglicemiei. Pacienții trebuie instruiți să ia Starlix 1 până la 30 de minute înainte de a ingera o masă, dar să sară doza programată dacă sar peste masă, astfel încât riscul de hipoglicemie să fie redus. Interacțiunile medicamentoase trebuie discutate cu pacienții. Pacienții trebuie informați despre interacțiunile potențial medicament cu Starlix.
Teste de laborator
Răspunsul la terapii trebuie evaluat periodic cu valorile glicemiei și nivelurile de HbA1C.
Interacțiunile medicamentoase
Nateglinida se leagă foarte mult de proteinele plasmatice (98%), în principal de albumină. Studii de deplasare in vitro cu medicamente cu legături ridicate de proteine, cum ar fi furosemidul, propranololul, captoprilul, nicardipina, pravastatina, glicurura, warfarina, fenitoina, acidul acetilsalicilic, tolbutamida și metformina nu au arătat nicio influență asupra extinderii proteinei nateglinide legare. În mod similar, nateglinida nu a avut nicio influență asupra legării proteinelor serice ale propranololului, glicuridei, nicardipinei, warfarinei, fenitoinei, acidului acetilsalicilic și tolbutamidei in vitro. Cu toate acestea, evaluarea prudentă a cazurilor individuale este justificată în mediul clinic.
Anumite medicamente, inclusiv agenți antiinflamatori nesteroizi (AINS), salicilați, inhibitori de monoaminoxidază și agenți de blocare beta-adrenergici neselectivi pot potența acțiunea hipoglicemică a Starlix și a altor antidiabetice orale droguri.
Anumite medicamente, inclusiv tiazide, corticosteroizi, produse tiroidiene și simpatomimetice pot reduce acțiunea hipoglicemică a Starlix și a altor medicamente antidiabetice orale.
Când aceste medicamente sunt administrate sau retrase de la pacienții care primesc Starlix, pacientul trebuie observat îndeaproape pentru modificări ale controlului glicemic.
Interacțiuni medicamente / alimente
Farmacocinetica nateglinidei nu a fost afectată de compoziția unei mese (proteine mari, grăsimi sau carbohidrați). Cu toate acestea, nivelurile plasmatice maxime au fost semnificativ reduse atunci când Starlix a fost administrat cu 10 minute înainte de o masă lichidă. Starlix nu a avut niciun efect asupra golirii gastrice la subiecți sănătoși, astfel cum a fost evaluat prin testarea cu acetaminofen.
Carcinogeneza / mutageneza / afectarea fertilitatii
Carcinogenitate: Un studiu de carcinogenitate de doi ani la șobolani Sprague-Dawley a fost efectuat cu doze orale de nateglinidă până la 900 mg / kg / zi, care au produs expuneri la ASC la șobolan masculin și feminin de aproximativ 30 și 40 de ori expunerea terapeutică umană, respectiv, cu o doză recomandată de Starlix de 120 mg, de trei ori pe zi înainte mese. Un studiu de doi ani asupra carcinogenității la șoarecii B6C3F1 a fost efectuat cu doze orale de nateglinidă de până la 400 mg / kg / zi, ceea ce a produs expuneri ale ASC la bărbați și șoarecii de sex feminin de aproximativ 10 și 30 de ori expunerea terapeutică umană cu o doză recomandată de Starlix de 120 mg, de trei ori pe zi înainte de masă. Nici o dovadă a unui răspuns tumoral nu a fost găsită la șobolani sau șoareci.
Mutageneză: Nateglinida nu a fost genotoxică în testul Ames in vitro, testul limfomului de șoarece, testul de aberație cromozomială în celulele pulmonare de hamster chinezesc sau în testul in vivo de micronucleu la șoarece.
Insuficiența fertilității: Fertilitatea nu a fost afectată prin administrarea de nateglinidă la șobolani în doze de până la 600 mg / kg (de aproximativ 16 ori expunerea terapeutică umană cu o doză recomandată de Starlix de 120 mg de trei ori pe zi înainte mese).
graviditate
Sarcina Categorie C
Nateglinida nu a fost teratogenă la șobolani în doze de până la 1000 mg / kg (de aproximativ 60 de ori expunerea terapeutică umană cu o doză recomandată de Starlix de 120 mg, de trei ori pe zi înainte de masă). La iepure, dezvoltarea embrionară a fost afectată negativ, iar incidența agenezei vezicii biliare sau a vezicii biliare mici a fost crescută la doză de 500 mg / kg (aproximativ 40 de ori expunerea terapeutică umană cu o doză recomandată de Starlix de 120 mg, de trei ori pe zi înainte mese). Nu există studii adecvate și bine controlate la gravide. Starlix nu trebuie utilizat în timpul sarcinii.
Muncă și livrare
Nu se cunoaște efectul Starlix asupra muncii și nașterii la oameni.
Mamele care alăptează
Studiile efectuate la șobolani care au alăptat au arătat că nateglinida este excretată în lapte; raportul AUC0-48h în lapte / plasmă a fost de aproximativ 1: 4. În perioada peri- și postnatală, ponderile corpului au fost mai mici la descendenții șobolanilor administrați cu nateglinidă la 1000 mg / kg (de aproximativ 60 de ori expunerea terapeutică umană cu o doză recomandată de Starlix de 120 mg, de trei ori pe zi înainte mese). Nu se cunoaște dacă Starlix este excretat în laptele uman. Deoarece multe medicamente sunt excretate în laptele uman, Starlix nu trebuie administrat unei femei care alăptează.
Utilizare pediatrică
Nu a fost stabilită siguranța și eficacitatea Starlix la pacienții pediatri.
Utilizare geriatrică
Nu au fost observate diferențe în ceea ce privește siguranța sau eficacitatea Starlix între pacienții cu vârsta peste 65 de ani și cei sub 65 de ani. Cu toate acestea, nu poate fi exclusă o mai mare sensibilitate a unor persoane în vârstă la terapia cu Starlix.
top
Reactii adverse
În studiile clinice, aproximativ 2.600 de pacienți cu diabet zaharat de tip 2 au fost tratați cu Starlix® (nateglinidă). Dintre aceștia, aproximativ 1.335 de pacienți au fost tratați timp de 6 luni sau mai mult și aproximativ 190 de pacienți pentru un an sau mai mult.
Hipoglicemia a fost relativ neobișnuită la toate brațele de tratament ale studiilor clinice. Doar 0,3% dintre pacienții cu Starlix au fost întreruși din cauza hipoglicemiei. Simptomele gastrointestinale, în special diaree și greață, nu au fost mai frecvente la pacienții care utilizează combinația de Starlix și metformină decât la pacienții care au primit metformină singură. De asemenea, edemul periferic nu a fost mai frecvent la pacienții care utilizează combinația de Starlix și rosiglitazonă decât la pacienții care au primit rosiglitazonă singură. Următorul tabel listează evenimentele care au avut loc mai frecvent la pacienții Starlix decât pacienții cu placebo în studiile clinice controlate.
Evenimente adverse adverse (‰ ¥ 2% la pacienții Starlix®) în studiile de monoterapie Starlix® (% dintre pacienți)
| placebo | Starlix® | |
| N = 458 | N = 1441 | |
| Termenul preferat | ||
| Infecție respiratorie superioara | 8.1 | 10.5 |
| Dureri de spate | 3.7 | 4.0 |
| Simptomele gripei | 2.6 | 3.6 |
| Ameţeală | 2.2 | 3.6 |
| artropatia | 2.2 | 3.3 |
| Diaree | 3.1 | 3.2 |
| Traumatisme accidentale | 1.7 | 2.9 |
| Bronşită | 2.6 | 2.7 |
| tușit | 2.2 | 2.4 |
| hipoglicemia | 0.4 | 2.4 |
În timpul experienței de după comercializare, au fost raportate cazuri rare de reacții de hipersensibilitate, cum ar fi erupții cutanate, mâncărime și urticarie. În mod similar, au fost raportate cazuri de icter, hepatită colestatică și enzime hepatice crescute.
Anomalii de laborator
Acid uric: Au existat creșteri ale nivelului mediu de acid uric pentru pacienții tratați numai cu Starlix, Starlix în combinație cu metformină, metformină singură și gliburidă singură. Diferențele respective față de placebo au fost 0,29 mg / dL, 0,45 mg / dL, 0,28 mg / dL și 0,19 mg / dL. Nu este cunoscută importanța clinică a acestor descoperiri.
top
Supradozarea
Într-un studiu clinic la pacienții cu diabet zaharat de tip 2, a fost administrat Starlix® (nateglinidă) creșterea dozelor până la 720 mg pe zi timp de 7 zile și nu au existat evenimente adverse semnificative clinic raportat. Nu au existat cazuri de supradozaj cu Starlix în studiile clinice. Cu toate acestea, o supradoză poate duce la un efect exagerat de scădere a glucozei odată cu dezvoltarea simptomelor hipoglicemice. Simptomele hipoglicemice fără pierderea cunoștinței sau descoperirile neurologice trebuie tratate cu glucoză orală și ajustări ale dozelor și / sau ale modelului de masă. Reacții hipoglicemice severe cu comă, convulsie sau alte simptome neurologice trebuie tratate cu glucoză intravenoasă. Deoarece nateglinida este legată de proteine, dializa nu este un mijloc eficient de eliminare a acesteia din sânge.
top
Dozaj si administrare
Starlix® (nateglinidă) trebuie luat cu 1 până la 30 minute înainte de masă.
Monoterapie și combinație cu Metformin sau o tiazolidinedione
Doza de început și întreținere recomandată de Starlix, singură sau în combinație cu metformină sau tiazolidinedione, este de 120 mg de trei ori pe zi înainte de masă.
Doza de 60 mg de Starlix, fie singură, fie în combinație cu metformină sau tiazolidinioneză, poate fi utilizată la pacienții care sunt aproape de obiectivul HbA1C la inițierea tratamentului.
Dozarea la pacienții geriatrici
De obicei, nu sunt necesare ajustări speciale ale dozei. Cu toate acestea, nu poate fi exclusă o mai mare sensibilitate a unor persoane la terapia cu Starlix.
Dozare în insuficiență renală și hepatică
Nu este necesară ajustarea dozei la pacienții cu insuficiență renală ușoară până la severă sau la pacienții cu insuficiență hepatică ușoară. Dozarea pacienților cu disfuncție hepatică moderată până la severă nu a fost studiată. Prin urmare, Starlix trebuie utilizat cu precauție la pacienții cu boală hepatică moderată până la severă (vezi PRECAUȚII, Insuficiență hepatică).
top
Cât este furnizat
Comprimate Starlix® (nateglinidă)
60 mg
Tabletă roz, rotundă, cu margine teșită, cu „Starlix” în relief pe o parte și „60” pe cealaltă.
Sticle de 100... NDC 0078-0351-05
120 mg
Tabletă galbenă, ovaloidă, cu „Starlix”, pusă pe o parte și „120” pe cealaltă.
Sticle de 100... NDC 0078-0352-05
Depozitare
A se păstra la 25 ºC (77 ºF); excursii permise la 15 ºC-30 ºC (59 ºF-86 ºF).
Aruncați într-un recipient etanș, USP.
T2008-01
REV: IULIE 2008
Produs de:
Novartis Pharma Stein AG
Stein, Elveția
Distribuit de:
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936
© Novartis
Ultima actualizare 07/2008
Starlix, nateglinidă, informații complete despre pacient (în engleză simplă)
Informații detaliate despre semne, simptome, cauze, tratamente ale diabetului
Informațiile din această monografie nu sunt destinate să acopere toate utilizările posibile, indicații, precauții, interacțiuni medicamentoase sau efecte adverse. Aceste informații sunt generalizate și nu sunt destinate unor sfaturi medicale specifice. Dacă aveți întrebări despre medicamentele pe care le luați sau doriți mai multe informații, consultați medicul, farmacistul sau asistenta medicală.
înapoi la: Căutați toate medicamentele pentru diabet

