Glucofag pentru tratamentul diabetului
Nume de marcă: Glucophage
Denumire generică: clorhidrat de metformină
Forma de dozare: comprimate cu eliberare extinsă
Cuprins:
Descriere
Farmacologie clinică
Indicații și utilizare
Contraindicații
Avertizări
Măsuri de precauție
Interacțiunile medicamentoase
Reactii adverse
Supradozaj
Dozare
furnizat
Glucohage, clorhidrat de metformină, informații despre pacient (în engleză simplă)
Descriere
Comprimatele Glucophage® (clorhidrat de metformină) și Glucophage® XR (clorhidrat de metformină) Comprimatele cu eliberare extinsă sunt medicamente antihiperglicemice orale utilizate în tratarea diabetului de tip 2. Clorhidratul de metformin (clorhidrat de N, N-dimetilimidodicarbonimidic) nu este legat chimic sau farmacologic de nici o altă clasă de agenți antihiperglicemici orali. Formula structurală este după cum se arată:
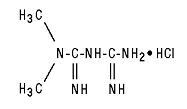
Clorhidratul de metformină este un compus cristalin alb până la alb, cu o formulă moleculară de C4H11N5 - HCl și o greutate moleculară de 165,63. Clorhidratul de metformin este solubil liber în apă și este practic insolubil în acetonă, eter și cloroform. PKa metforminei este 12.4. PH-ul unei soluții apoase 1% de clorhidrat de metformină este 6,68.
Comprimatele de glucofag conțin clorhidrat de metformin 500 mg, 850 mg sau 1000 mg. Fiecare comprimat conține ingrediente inactive povidone și stearat de magneziu. În plus, acoperirea pentru tabletele de 500 mg și 850 mg conține hippromeloză, iar acoperirea pentru comprimatul de 1000 mg conține hippromeloză și polietilenglicol.
Glucophage XR conține 500 mg sau 750 mg de clorhidrat de metformină ca ingredient activ.
Comprimatele Glucophage XR 500 mg conțin ingrediente inactive carboximetil celuloză de sodiu, hipromeloză, celuloză microcristalină și stearat de magneziu.
Comprimatele Glucophage XR 750 mg conțin ingrediente inactive carboximetil celuloză de sodiu, hipromeloză și stearat de magneziu.
Componente de sistem și Performance-Glucophage XR cuprinde un sistem dublu de matrice polimer hidrofil. Clorhidratul de metformină este combinat cu un polimer care controlează eliberarea de medicamente pentru a forma o fază "interioară", care este apoi încorporată ca particule discrete într-o fază "externă" a unui al doilea polimer. După administrare, lichidul din tractul gastro-intestinal (GI) intră în comprimat, determinând hidratarea și umflarea polimerilor. Medicamentul este eliberat lent din forma de dozare printr-un proces de difuzie prin matricea de gel care este esențial independentă de pH. Sistemul de polimeri hidratat nu este rigid și este de așteptat să fie rupt de peristaltismul normal în tractul GI. Componentele biologice inerte ale comprimatului pot rămâne ocazional intacte în timpul tranzitului GI și vor fi eliminate în materiile fecale sub formă de masă moale, hidratată.
top
Farmacologie clinică
Mecanism de acțiune
Metformin este un agent antihiperglicemic care îmbunătățește toleranța la glucoză la pacienții cu diabet zaharat tip 2, scăzând atât glucoza plasmatică bazală cât și cea postprandială. Mecanismele sale de acțiune farmacologice sunt diferite de alte clase de agenți antihiperglicemici orali. Metformin scade producția de glucoză hepatică, scade absorbția intestinală a glucozei și îmbunătățește sensibilitatea la insulină prin creșterea absorbției periferice a glicemiei și utilizarea. Spre deosebire de sulfoniluree, metformina nu produce hipoglicemie nici la pacienții cu diabet de tip 2, nici la subiecți normali (cu excepția unor circumstanțe speciale, vezi PRECAUȚII) și nu provoacă hiperinsulinemie. Odată cu terapia cu metformină, secreția de insulină rămâne neschimbată, în timp ce nivelul de insulină al jeunului și răspunsul insulinei plasmatice pe parcursul zilei pot scădea efectiv.
Farmacocinetica
Absorbție și biodisponibilitate
Biodisponibilitatea absolută a unui comprimat Glucophage 500 mg administrat în condiții de repaus alimentar este de aproximativ 50% până la 60%. Studiile care utilizează doze orale unice de Glucofag între 500 și 1500 mg și 850 până la 2550 mg indică faptul că lipsește proporționalitatea dozei cu doze în creștere, care se datorează scăderii absorbției, mai degrabă decât unei modificări în eliminare. Alimentele scad amploarea și întârzie ușor absorbția metforminei, așa cum este arătat cu aproximativ 40% plasmă medie maximă concentrație (Cmax), o suprafață mai mică cu 25% sub concentrația plasmatică față de curba de timp (ASC) și o prelungire de 35 de minute a picului concentrație plasmatică (Tmax) după administrarea unei singure comprimate de 850 mg de metformină cu alimente, comparativ cu aceeași concentrație a tabletei administrată post. Nu se cunoaște relevanța clinică a acestor scăderi.
După o singură doză orală de Glucophage XR, Cmax este obținut cu o valoare mediană de 7 ore și un interval de 4 până la 8 ore. Nivelurile plasmatice maxime sunt cu aproximativ 20% mai mici în comparație cu aceeași doză de Glucofag, cu toate acestea, gradul de absorbție (măsurat de ASC) este similar cu Glucophage.
În stare de echilibru, ASC și Cmax sunt mai mici decât proporțional cu doza pentru Glucophage XR în intervalul de 500 până la 2000 mg administrate o dată pe zi. Nivelurile plasmatice maxime sunt de aproximativ 0,6, 1,1, 1,4 și 1,8 ug / ml pentru doze de 500, 1000, 1500 și 2000 mg, respectiv o dată pe zi. Măsura absorbției de metformină (măsurată de ASC) de la Glucophage XR la o doză de 2000 mg o dată pe zi este similară cu aceeași doză zilnică totală administrată ca Glucophage comprimate 1000 mg de două ori pe zi. După administrarea repetată a Glucophage XR, metformina nu s-a acumulat în plasmă.
Variabilitatea în interiorul subiectului în Cmax și ASC a metforminei de la Glucophage XR este comparabilă cu cea cu Glucophage.
Deși amploarea absorbției metforminei (măsurată de ASC) din comprimatul Glucophage XR crescut cu aproximativ 50% la administrarea cu alimente, nu a existat niciun efect asupra alimentelor asupra Cmax și Tmax din metformină. Atât mesele bogate, cât și cele cu conținut scăzut de grăsimi au avut același efect asupra farmacocineticii Glucophage XR.
distribuire
Volumul aparent de distribuție (V / F) de metformină în urma dozelor orale unice de Glucofag 850 mg a fost în medie de 654 ± 358 L. Metformina este legată în mod neglijabil de proteinele plasmatice, spre deosebire de sulfoniluree, care sunt mai mult de 90% legate de proteine. Metformin se desparte în eritrocite, cel mai probabil ca funcție a timpului. La dozele clinice obișnuite și programele de dozare de Glucophage, concentrațiile plasmatice de metformină în stare constantă sunt atinse în 24 până la 48 de ore și sunt în general
Metabolism și eliminare
Studiile intravenoase cu o singură doză la subiecți normali demonstrează că metforminul este excretat neschimbat în urină și nu suferă metabolism hepatic (nu s-au identificat metaboliți la om) și nici biliar excreţie. Clearance-ul renal (vezi tabelul 1) este de aproximativ 3,5 ori mai mare decât clearance-ul creatininei, ceea ce indică faptul că secreția tubulară este calea principală de eliminare a metforminei. După administrarea orală, aproximativ 90% din medicamentul absorbit este eliminat pe calea renală în primele 24 de ore, cu un timp de înjumătățire plasmatică de eliminare de aproximativ 6,2 ore. În sânge, timpul de înjumătățire prin eliminare este de aproximativ 17,6 ore, ceea ce sugerează că masa eritrocitelor poate fi un compartiment de distribuție.
Populații speciale
Pacienți cu diabet zaharat tip 2
În prezența funcției renale normale, nu există diferențe între farmacocinetica cu o singură sau mai multe doze multiple de metformină între pacienții cu diabet zaharat tip 2 și subiecții normali (vezi tabelul 1), nici nu există o acumulare de metformină în niciun grup în doze clinice obișnuite.
Farmacocinetica Glucophage XR la pacienții cu diabet zaharat tip 2 sunt comparabile cu cele la adulți sănătoși normali.
Insuficiență renală
La pacienții cu funcție renală scăzută (bazată pe clearance-ul creatininei măsurate), plasmă și timpul de înjumătățire plasmatică metformina este prelungită și clearance-ul renal este scăzut proporțional cu scăderea clearance-ului creatininei (vezi tabelul 1; vezi de asemenea AVERTIZĂRI).
Insuficiență hepatică
Nu s-au efectuat studii farmacocinetice ale metforminei la pacienții cu insuficiență hepatică.
Geriatrie
Datele limitate obținute din studiile farmacocinetice controlate ale Glucofagului la subiecți în vârstă sănătoși sugerează că plasmă totală clearance-ul metforminei este scăzut, timpul de înjumătățire este prelungit și Cmax este crescut, comparativ cu tinerii sănătoși subiecți. Din aceste date, se pare că modificarea farmacocineticii metforminei odată cu îmbătrânirea este contabilizată în principal de o modificare a funcției renale (vezi tabelul 1). Comprimatele cu Glucophage (clorhidrat de metformin) și Glucophage XR (clorhidrat de metformin) Tratamentul cu comprimate cu eliberare extinsă nu trebuie fi inițiat la pacienți cu vârsta de 80 de ani, cu excepția cazului în care măsurarea clearance-ului creatininei demonstrează că funcția renală nu este redusă (vedea AVERTIZĂRI și DOZAJ SI ADMINISTRARE).
Tabelul 1: Selectarea mediei (± S.D.) Parametrii farmacocinetici ai metforminei după doze orale multiple sau multiple ale glucofagului
| Grupuri de subiecți: doza de glucofagA (număr de subiecți) |
Cmaxb (pg / ml) |
Tmaxc (ore) |
Clearance-ul renal (Ml / min) |
|---|---|---|---|
| A Toate dozele date pe post, cu excepția primelor 18 doze ale studiilor cu doze multiple | |||
| b Concentrația plasmatică maximă | |||
| c Timpul maxim de concentrație plasmatică | |||
| d Rezultate combinate (medie) a cinci studii: vârsta medie 32 ani (intervalul 23-59 ani) | |||
| e Studiul cinetic efectuat după doza 19, administrată cu post | |||
| f Subiecții vârstnici, vârsta medie de 71 ani (intervalul 65-81 ani) | |||
| g CLcr = clearance-ul creatininei normalizat la suprafața corpului de 1,73 m2 | |||
| Adulți sănătoși, nondiabetici: | |||
| 500 mg doză unică (24) | 1.03 ( ±0.33) | 2.75 ( ±0.81) | 600 ( ±132) |
| 850 mg doză unică (74)d | 1.60 ( ±0.38) | 2.64 ( ±0.82) | 552 ( ±139) |
| 850 mg de trei ori pe zi pentru 19 dozee (9) | 2.01 ( ±0.42) | 1.79 ( ±0.94) | 642 ( ±173) |
| Adulți cu diabet zaharat tip 2: | |||
| 850 mg doză unică (23) | 1.48 ( ±0.5) | 3.32 ( ±1.08) | 491 ( ±138) |
| 850 mg de trei ori pe zi pentru 19 dozee (9) | 1.90 ( ±0.62) | 2.01 ( ±1.22) | 550 ( ±160) |
| vârstnicf, adulți sănătoși nondiabetici: | |||
| 850 mg doză unică (12) | 2.45 ( ±0.70) | 2.71 ( ±1.05) | 412 ( ±98) |
| Adulți cu insuficiență renală: | |||
| 850 mg doză unică | |||
| Ușoară (CLcrg 61-90 ml / min) (5) | 1.86 ( ±0.52) | 3.20 ( ±0.45) | 384 ( ±122) |
| Moderat (CLcr 31-60 ml / min) (4) | 4.12 ( ±1.83) | 3.75 ( ±0.50) | 108 ( ±57) |
| Severa (CLcr 10-30 ml / min) (6) | 3.93 ( ±0.92) | 4.01 ( ±1.10) | 130 ( ±90 |
Pediatrie
După administrarea unui comprimat oral Glucophage de 500 mg cu alimente, metformin Cmax mediu și ASC au diferit sub 5% între pacienți diabetici de tip 2 pediatri (12-16 ani) și adulți sănătoși potriviți în funcție de sex și greutate (20-45 ani), cu toți renali normali funcţie
Sex
Parametrii farmacocinetici ai metforminei nu au diferit în mod semnificativ între subiecții normali și pacienții cu diabet zaharat tip 2 atunci când au fost analizați în funcție de gen (bărbați = 19, femei = 16). În mod similar, în studiile clinice controlate la pacienții cu diabet de tip 2, efectul antihiperglicemic al Glucofagului a fost comparabil la bărbați și femei.
Cursă
Nu au fost efectuate studii privind parametrii farmacocinetici ai metforminei în funcție de rasă. În studiile clinice controlate ale Glucofagului la pacienții cu diabet zaharat de tip 2, efectul antihiperglicemic a fost comparabil la alb (n = 249), negri (n = 51) și hispanici (n = 24).
Studii clinice
Glucophage
Într-un studiu clinic multicentric din SUA, dublu orb, controlat cu placebo, care a implicat pacienți obezi cu diabet de tip 2 a căror hiperglicemie nu a fost controlată în mod adecvat cu administrarea dietetică singură (glucoză plasmatică cu administrare inițială [FPG] de aproximativ 240 mg / dL), tratamentul cu Glucofag (până la 2550 mg / zi) timp de 29 de săptămâni a avut ca rezultat semnificativ reduceri nete medii ale glucozei plasmatice post și postprandiale (PPG) și a hemoglobinei A1c (HbA1c) de 59 mg / dL, 83 mg / dL și, respectiv, 1,8%, comparativ cu grupul placebo (vezi Masa 2).
Tabelul 2: Glucofag vs. Rezumat placebo al modificărilor medii de la nivelul inițial * în glucoză cu plasmă de post, HbA1c, și greutatea corporală, la vizita finală (studiu de 29 de săptămâni)
| Glucophage (N = 141) |
placebo (N = 145) |
Valoare p | |
|---|---|---|---|
| * Toți pacienții aflați în terapie dietetică la Baseline | ** Nu semnificativ statistic | ||
| FPG (mg / dL) De bază Schimbare la VIZITĂ FINALĂ |
241.5 -53.0 |
237.7 6.3 |
NS ** 0.001 |
| Hemoglobina A1c (%) De bază Schimbare la VIZITĂ FINALĂ |
8.4 -1.4 |
8.2 0.4 |
NS ** 0.001 |
| Greutate corporală (lbs) De bază Schimbare la VIZITĂ FINALĂ |
201.0 -1.4 |
206.0 -2.4 |
NS ** NS ** |
Un studiu de 29 de săptămâni, dublu orb, controlat cu placebo al Glucophage și glicburide, singur și în combinație, a fost realizat la pacienții obezi cu tipul 2 diabet care nu a reușit să obțină un control glicemic adecvat în timpul administrării unor doze maxime de glicuridă (FPG de bază de aproximativ 250 mg / dL) (vezi Tabelul 3). Pacienții randomizați la brațul combinat au început terapia cu Glucophage 500 mg și glicuridă 20 mg. La sfârșitul fiecărei săptămâni din primele 4 săptămâni ale studiului, acești pacienți și-au crescut dozele de Glucofag cu 500 mg dacă nu au reușit să atingă glucoza plasmatică în condiții de repaus. După săptămâna 4, astfel de ajustări ale dozei au fost efectuate lunar, deși niciun pacient nu a fost permis să depășească Glucophage 2500 mg. Pacienții din brațul Glucophage (metformin plus placebo) au urmat același program de titrare. La sfârșitul studiului, aproximativ 70% dintre pacienții din grupul asociat au luat Glucophage 2000 mg / glicuridă 20 mg sau Glucophage 2500 mg / glicburidă 20 mg. Pacienții randomizați pentru a continua pe glicuridă au înregistrat o agravare a controlului glicemic, cu creșteri medii ale FPG, PPG și HbA1c de 14 mg / dL, 3 mg / dL, respectiv 0,2%. În schimb, cei randomizați cu Glucofag (până la 2500 mg / zi) au înregistrat o ușoară îmbunătățire, cu reduceri medii ale FPG, PPG și HbA1c de 1 mg / dL, 6 mg / dL, respectiv 0,4%. Combinația de Glucofag și glicurură a fost eficientă în reducerea nivelurilor de FPG, PPG și HbA1c cu 63 mg / dL, 65 mg / dL și, respectiv, cu 1,7%. Comparativ cu rezultatele tratamentului cu glicuridă, diferențele nete cu tratamentul combinat au fost -77 mg / dL, -68 mg / dL, respectiv -1,9% (vezi Tabelul 3).
Tabelul 3: Monoterapie Glucofagă / Glicbură (Pieptene) vs Glicburidă (Glyb) sau Glucofag (GLU): Rezumatul modificărilor medii de la nivelul de bază * în glucoza cu plasmă de post, HbA1c, și greutatea corporală, la vizita finală (studiu de 29 de săptămâni)
| valori p | ||||||
|---|---|---|---|---|---|---|
| Pieptene (N = 213) |
Glyb (N = 209) |
GLU (N = 210) |
Glyb vs. Pieptene |
GLU vs. Pieptene |
GLU vs. Glyb |
|
| * Toți pacienții cu glicuridă, 20 mg / zi, la inițial | ** Nu semnificativ statistic | |||||
| Glucoză cu plasmă de post (mg / dL) | ||||||
| De bază Schimbare la VIZITĂ FINALĂ |
250.5 -63.5 |
247.5 13.7 |
253.9 -0.9 |
NS ** 0.001 |
NS ** 0.001 |
NS ** 0.025 |
| Hemoglobina A1c (%) | ||||||
| De bază Schimbare la VIZITĂ FINALĂ |
8.8 -1.7 |
8.5 0.2 |
8.9 -0.4 |
NS ** 0.001 |
NS ** 0.001 |
0.007 0.001 |
| Greutate corporală (lbs) | ||||||
| De bază Schimbare la VIZITĂ FINALĂ |
202.2 0.9 |
203.0 -0.7 |
204.0 -8.4 |
NS ** 0.011 |
NS ** 0.001 |
NS ** 0.001 |
Mărimea declinului concentrației de glucoză în sânge în urma instituirii Glucofagul (clorhidrat de metformin) Terapia cu tablete a fost proporțională cu nivelul de post hiperglicemie. Pacienții cu diabet zaharat de tip 2 cu concentrații mai mari de glucoză în condiții de repaus alimentar au înregistrat scăderi mai mari ale glucozei plasmatice și a hemoglobinei glicozilate.
În studiile clinice, Glucophage, singur sau în combinație cu o sulfonilurea, a scăzut serul mediu de post trigliceride, colesterol total și nivel de colesterol LDL și nu au avut efecte adverse asupra altor niveluri de lipide (vezi Tabelul 4).
Tabelul 4: Rezumatul modificării procentei medii de la valorile de bază ale variabilelor majore ale lipidelor serice la vizita finală (studii de 29 de săptămâni)
| Glucofag vs Placebo | Glucofag combinat / glicurură vs Monoterapie |
||||
|---|---|---|---|---|---|
| Glucophage (N = 141) |
placebo (N = 145) |
Glucophage (N = 210) |
Glucophage / Glyburida (N = 213) |
Glyburida (N = 209) |
|
| Colesterol total (mg / dL) | |||||
| De bază Media modificării% la VIZITĂ FINALĂ |
211.0 -5% |
212.3 1% |
213.1 -2% |
215.6 -4% |
219.6 1% |
| Trigliceride totale (mg / dL) | |||||
| De bază Media modificării% la VIZITĂ FINALĂ |
236.1 -16% |
203.5 1% |
242.5 -3% |
215.0 -8% |
266.1 4% |
| LDL-Colesterol (mg / dL) | |||||
| De bază Media modificării% la VIZITĂ FINALĂ |
135.4 -8% |
138.5 1% |
134.3 -4% |
136.0 -6% |
137.5 3% |
| HDL-Colesterol (mg / dL) | |||||
| De bază Media modificării% la VIZITĂ FINALĂ |
39.0 2% |
40.5 -1% |
37.2 5% |
39.0 3% |
37.0 1% |
Spre deosebire de sulfoniluree, greutatea corporală a persoanelor de pe Glucophage a avut tendința de a rămâne stabilă sau chiar de a scădea oarecum (vezi Tabelele 2 și 3).
Un studiu de 24 de săptămâni, dublu orb, controlat cu placebo asupra Glucophage plus insulină versus insulină plus placebo a fost efectuate la pacienții cu diabet zaharat de tip 2 care nu au reușit să obțină un control glicemic adecvat doar asupra insulinei (vezi Tabelul 5). Pacienții randomizați pentru a primi Glucophage plus insulină au obținut o reducere a HbA1c cu 2,10%, comparativ cu o reducere de H6A1c de 1,56% obținută de insulină plus placebo. Îmbunătățirea controlului glicemic a fost obținută la ultima vizită de studiu cu 16% mai puțină insulină, 93,0 U / zi față de 110,6 U / zi, Glucofag plus insulină versus insulină plus placebo, respectiv p = 0,04.
Tabelul 5: Glucofag combinat / insulină vs placebo / insulină Rezumatul modificărilor medii de la valoarea inițială în HbA1c și doza zilnică de insulină
| Glucophage / Insulină (N = 26) |
placebo / Insulină (N = 28) |
Tratament Diferență Media ± SE |
|
|---|---|---|---|
|
A Statistic semnificativ folosind analiza covarianței cu valoarea inițială ca covariate (p = 0.04) Nu este semnificativ folosind analiza varianței (valorile prezentate în tabel) | |||
| b Statistic semnificativ pentru insulină (p = 0,04) | |||
| Hemoglobina A1c (%) | |||
| De bază Schimbare la VIZITĂ FINALĂ |
8.95 -2.10 |
9.32 -1.56 |
-0.54 ± 0.43A |
| Doza de insulină (U / zi) | |||
| De bază Schimbare la VIZITĂ FINALĂ |
93.12 -0.15 |
94.64 15.93 |
-16.08 ± 7.77b |
Un al doilea studiu dublu-orb, controlat cu placebo (n = 51), cu 16 săptămâni de tratament randomizat, a demonstrat că la pacienții cu diabet zaharat tip 2, controlat pe insulină timp de 8 săptămâni cu o medie HbA1c de 7,46 ± 0,97%, adăugarea Glucofagului a menținut un control glicemic similar (HbA1c 7,15 ± 0,61 vs 6,97 ± 0,62 pentru Glucophage plus insulină și placebo plus insulină) cu 19% mai puțină insulină față de valoarea inițială (reducere de 23,68 ± 30,22 față de o creștere de 0,43 ± 25,20 unități pentru Glucophage plus insulină și placebo plus insulină, p <0,01). În plus, acest studiu a demonstrat că combinația de Glucophage plus insulină a dus la reducerea în greutate corporală de 3,11 ± 4,30 lbs, comparativ cu o creștere de 1,30 ± 6,08 lbs pentru placebo plus insulină, p = 0,01.
Glucofag XR
Un studiu de 24 de săptămâni, dublu orb, controlat cu placebo, al Glucophage XR, efectuat o dată pe zi cu masa de seară, a fost efectuat în pacienți cu diabet de tip 2 care nu au reușit să obțină controlul glicemic cu dieta și exercițiile fizice (HbA1c 7,0% -10,0%, FPG 126-270 mg / dl). Pacienții care au intrat în studiu au avut o valoare medie de referință HbA1c de 8,0% și o medie medie FPG de 176 mg / dL. După 12 săptămâni de tratament, media HbA1c a crescut de la nivelul inițial cu 0,1% și media FPG a scăzut de la nivelul inițial cu 2 mg / dL în grupul placebo, comparativ cu o scădere a mediei HbA1c de 0,6% și o scădere a FPG mediu de 23 mg / dL la pacienții tratați cu Glucophage XR 1000 mg o dată zilnic. Ulterior, doza de tratament a fost crescută la 1500 mg o dată pe zi, dacă HbA1c a fost 7,0%, dar <8,0% (pacienții cu HbA1c - 8,0% au fost întreruși din studiu). La ultima vizită (24 de săptămâni), HbA1c medie a crescut cu 0,2% față de valoarea inițială la pacienții cu placebo și a scăzut cu 0,6% cu Glucophage XR.
Un studiu de 16-săptămâni, dublu-orb, controlat cu placebo, cu răspuns la doză a Glucophage XR, efectuat o dată pe zi cu masa de seară sau de două ori pe zi, cu mese, a fost efectuat la pacienții cu diabet zaharat de tip 2 care nu au reușit să atingă controlul glicemic cu dieta și exercițiile fizice (HbA1c 7,0% -11,0%, FPG 126-280 mg / dl). Modificările controlului glicemic și ale greutății corporale sunt prezentate în tabelul 6.
Tabelul 6: Rezumatul modificărilor medii de la valoarea de bază * în HbA1c, Glucoză plasmatică cu post și greutate corporală la vizita finală (studiu de 16 săptămâni)
| Glucofag XR | placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg O singura data Zilnic |
1000 mg O singura data Zilnic |
1500 mg O singura data Zilnic |
2000 mg O singura data Zilnic |
1000 mg De două ori Zilnic |
||
| * Toți pacienții aflați în terapie dietetică la Baseline | ||||||
| A Toate comparațiile față de Placebo | ||||||
| ** Nu semnificativ statistic | ||||||
| Hemoglobina A1c (%) | (N = 115) | (N = 115) | (N = 111) | (N = 125) | (N = 112) | (N = 111) |
| De bază | 8.2 | 8.4 | 8.3 | 8.4 | 8.4 | 8.4 |
| Schimbare la VIZITĂ FINALĂ | -0.4 | -0.6 | -0.9 | -0.8 | -1.1 | 0.1 |
| Valoarea pA | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| FPG (mg / dL) | (N = 126) | (N = 118) | (N = 120) | (N = 132) | (N = 122) | (N = 113) |
| De bază | 182.7 | 183.7 | 178.9 | 181.0 | 181.6 | 179.6 |
| Schimbare la VIZITĂ FINALĂ | -15.2 | -19.3 | -28.5 | -29.9 | -33.6 | 7.6 |
| Valoarea pA | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| Greutate corporală (lbs) | (N = 125) | (N = 119) | (N = 117) | (N = 131) | (N = 119) | (N = 113) |
| De bază | 192.9 | 191.8 | 188.3 | 195.4 | 192.5 | 194.3 |
| Schimbare la VIZITĂ FINALĂ | -1.3 | -1.3 | -0.7 | -1.5 | -2.2 | -1.8 |
| Valoarea pA | NS ** | NS ** | NS ** | NS ** | NS ** | - |
Comparativ cu placebo, s-a observat o îmbunătățire a controlului glicemic la toate nivelurile de doză de Glucophage XR (metformin clorhidrat) Comprimate cu eliberare prelungită și tratamentul nu a fost asociat cu nicio schimbare semnificativă în greutate (vedea DOZAJ SI ADMINISTRARE pentru recomandări de dozare pentru Glucophage și Glucophage XR).
Un studiu de 24 de săptămâni, dublu-orb, randomizat al Glucophage XR, luat o dată pe zi cu masa de seară și Glucophage (clorhidrat de metformin), administrat de două ori pe zi (cu mic dejun și masă de seară), a fost efectuat la pacienții cu diabet zaharat tip 2 care au fost tratate cu Glucophage 500 mg de două ori pe zi timp de cel puțin 8 săptămâni înainte de intrarea în studiu. Doza de Glucofag nu a fost necesară pentru a atinge un nivel specific de control glicemic înainte de intrarea în studiu. Pacienții calificați pentru studiu dacă HbA1c a fost 88,5% și FPG a fost 200200 mg / dL. Modificările controlului glicemic și ale greutății corporale sunt prezentate în tabelul 7.
Tabelul 7: Rezumatul modificărilor medii de la valoarea de bază * în HbA1c, Glucoză plasmatică de post și greutatea corporală în săptămâna 12 și la vizita finală (studiu de 24 de săptămâni)
| Glucophage 500 mg De doua ori pe zi |
Glucofag XR | ||
|---|---|---|---|
| 1000 mg Odata pe zi |
1500 mg Odata pe zi |
||
| * Toți pacienții cu Glucophage 500 mg de două ori pe zi la Baseline | |||
| A n = 68 | |||
| Hemoglobina A1c (%) | (N = 67) | (N = 72) | (N = 66) |
| De bază | 7.06 | 6.99 | 7.02 |
| Schimbare la 12 săptămâni | 0.14 | 0.23 | 0.04 |
| (IC 95%) | (-0.03, 0.31) | (0.10, 0.36) | (-0.08, 0.15) |
| Schimbare la VIZITĂ FINALĂ | 0.14A | 0.27 | 0.13 |
| (IC 95%) | (-0.04, 0.31) | (0.11, 0.43) | (-0.02, 0.28) |
| FPG (mg / dL) | (N = 69) | (N = 72) | (N = 70) |
| De bază | 127.2 | 131.0 | 131.4 |
| Schimbare la 12 săptămâni | 12.9 | 9.5 | 3.7 |
| (IC 95%) | (6.5, 19.4) | (4.4, 14.6) | (-0.4, 7.8) |
| Schimbare la VIZITĂ FINALĂ | 14.0 | 11.5 | 7.6 |
| (IC 95%) | (7.0, 21.0) | (4.4, 18.6) | (1.0, 14.2) |
| Greutate corporală (lbs) | (N = 71) | (N = 74) | (N = 71) |
| De bază | 210.3 | 202.8 | 192.7 |
| Schimbare la 12 săptămâni | 0.4 | 0.9 | 0.7 |
| (IC 95%) | (-0.4, 1.5) | (0.0, 2.0) | (-0.4, 1.8) |
| Schimbare la VIZITĂ FINALĂ | 0.9 | 1.1 | 0.9 |
| (IC 95%) | (-0.4, 2.2) | (-0.2, 2.4) | (-0.4, 2.0) |
După 12 săptămâni de tratament, a existat o creștere a HbA medie1c în toate grupurile; în grupul Glucophage XR 1000 mg, creșterea de la nivelul inițial de 0,23% a fost semnificativă statistic (vezi DOZAJ SI ADMINISTRARE).
Modificările parametrilor lipidici în studiul de răspuns al dozei controlat cu placebo controlat cu placebo al Glucophage XR sunt prezentate în tabelul 8.
Tabelul 8: Rezumatul modificărilor procentei medii de la valoarea inițială * în variabilele majore ale lipidelor la vizita finală (studiu de 16 săptămâni)
| Glucofag XR | placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg O singura data Zilnic |
1000 mg O singura data Zilnic |
1500 mg O singura data Zilnic |
2000 mg O singura data Zilnic |
1000 mg De două ori Zilnic |
||
| * Toți pacienții aflați în terapie dietetică la Baseline | ||||||
| Colesterol total (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| De bază | 210.3 | 218.1 | 214.6 | 204.4 | 208.2 | 208.6 |
| Media modificării% la VIZITĂ FINALĂ | 1.0% | 1.7% | 0.7% | -1.6% | -2.6% | 2.6% |
| Trigliceride totale (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| De bază | 220.2 | 211.9 | 198.0 | 194.2 | 179.0 | 211.7 |
| Media modificării% la VIZITĂ FINALĂ | 14.5% | 9.4% | 15.1% | 14.9% | 9.4% | 10.9% |
| LDL-Colesterol (mg / dL) | (N = 119) | (N = 113) | (N = 109) | (N = 126) | (N = 117) | (N = 107) |
| De bază | 131.0 | 134.9 | 135.8 | 125.8 | 131.4 | 131.9 |
| Media modificării% la VIZITĂ FINALĂ | -1.4% | -1.6% | -3.5% | -3.3% | -5.5% | 3.2% |
| HDL-Colesterol (mg / dL) | (N = 120) | (N = 108) | (N = 108) | (N = 125) | (N = 117) | (N = 108) |
| De bază | 40.8 | 41.6 | 40.6 | 40.2 | 42.4 | 39.4 |
| Media modificării% la VIZITĂ FINALĂ | 6.2% | 8.6% | 5.5% | 6.1% | 7.1% | 5.8% |
Modificările parametrilor lipidici din studiul descris anterior asupra Glucophage și Glucophage XR sunt prezentate în tabelul 9.
Tabelul 9: Rezumatul modificărilor procentei medii de la valoarea inițială * în variabilele majore ale lipidelor la vizita finală (studiu de 24 de săptămâni)
| Glucophage | Glucofag XR | ||
|---|---|---|---|
| 500 mg De doua ori pe zi |
1000 mg Odata pe zi |
1500 mg Odata pe zi |
|
| * Toți pacienții cu Glucophage 500 mg de două ori pe zi la Baseline | |||
| Colesterol total (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| De bază | 199.0 | 201.9 | 201.6 |
| Media modificării% la VIZITĂ FINALĂ | 0.1% | 1.3% | 0.1% |
| Trigliceride totale (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| De bază | 178.0 | 169.2 | 206.8 |
| Media modificării% la VIZITĂ FINALĂ | 6.3% | 25.3% | 33.4% |
| LDL-Colesterol (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| De bază | 122.1 | 126.2 | 115.7 |
| Media modificării% la VIZITĂ FINALĂ | −1.3% | −3.3% | −3.7% |
| HDL-Colesterol (mg / dL) | (N = 68) | (N = 70) | (N = 65) |
| De bază | 41.9 | 41.7 | 44.6 |
| Media modificării% la VIZITĂ FINALĂ | 4.8% | 1.0% | -2.1% |
Studii clinice pediatrice
Într-un studiu dublu-orb, controlat cu placebo, la pacienți pediatrici cu vârsta cuprinsă între 10 și 16 ani, cu diabet zaharat tip 2 (medie FPG 182,2 mg / dL), tratamentul cu Glucofag (până în 2000 mg / zi) timp de până la 16 săptămâni (durata medie a tratamentului 11 săptămâni) a dus la o reducere netă semnificativă medie a FPG de 64,3 mg / dL, comparativ cu placebo (vezi Tabelul 10).
Tabelul 10: Glucofag vs Placebo (pediatrieA) Rezumatul modificărilor medii de la nivelul inițial * în glucoză plasmatică și greutatea corporală la vizita finală
| Glucophage | placebo | Valoare p | |
|---|---|---|---|
| A Pacienții pediatrici au vârsta de 13,8 ani (intervalul 10-16 ani) | |||
| * Toți pacienții aflați în terapie dietetică la Baseline | |||
| ** Nu semnificativ statistic | |||
| FPG (mg / dL) | (N = 37) | (N = 36) | |
| De bază Schimbare la VIZITĂ FINALĂ |
162.4 -42.9 |
192.3 21.4 |
<0.001 |
| Greutate corporală (lbs) | (N = 39) | (N = 38) | |
| De bază Schimbare la VIZITĂ FINALĂ |
205.3 -3.3 |
189.0 -2.0 |
NS ** |
top
Indicații și utilizare
Glucofag (clorhidrat de metformină) Tabletele sunt indicate ca adjuvant la dietă și exerciții fizice pentru a îmbunătăți controlul glicemic la adulți și copii cu diabet zaharat de tip 2.
Glucophage XR (metformin clorhidrat) Comprimate cu eliberare extinsă sunt indicate ca adjuvant la dietă și exerciții fizice pentru a îmbunătăți controlul glicemic la adulții cu diabet zaharat de tip 2.
top
Contraindicații
Glucophage și Glucophage XR sunt contraindicate la pacienții cu:
Boală renală sau disfuncție renală (de exemplu, așa cum este sugerat de nivelurile de creatinină serică ‰ ¥ 1,5 mg / dL [bărbați], ‰ ¥ 1,4 mg / dL [femei] sau anormale clearance-ul creatininei) care poate rezulta și din afecțiuni precum colapsul cardiovascular (șoc), infarct miocardic acut și septicemie (vedea AVERTIZĂRI și PRECAUȚII).
Hipersensibilitate cunoscută la clorhidrat de metformină.
Acidoză metabolică acută sau cronică, incluzând cetoacidoza diabetică, cu sau fără comă. Cetoacidoza diabetică trebuie tratată cu insulină.
Glucophage și Glucophage XR trebuie întrerupte temporar la pacienții care urmează studii radiologice implicate administrarea intravasculară a materialelor de contrast iodate, deoarece utilizarea acestor produse poate duce la alterarea acută a functie renala. (Vezi si PRECAUȚII.)
top
Avertizări
Acidoză lactică:
Acidoza lactică este o complicație metabolică rară, dar gravă, care poate apărea din cauza acumulării de metformină în timpul tratamentului cu Glucophage sau Glucophage XR; când apare, acesta este fatal în aproximativ 50% din cazuri. Acidoza lactică poate apărea, de asemenea, în asociere cu o serie de afecțiuni fiziopatologice, inclusiv diabetul zaharat, și ori de câte ori există hipoperfuzie tisulară și hipoxemie semnificativă. Acidoza lactică este caracterizată de niveluri crescute de lactat din sânge (> 5 mmol / L), scăderea pH-ului sanguin, tulburări de electroliți cu un decalaj anion crescut și un raport crescut de lactat / piruvat. Când metformina este implicată ca cauză a acidozei lactice, se găsesc în general niveluri plasmatice de metformină> 5 pg / ml.
Incidența raportată a acidozei lactice la pacienții care primesc clorhidrat de metformină este foarte mică (aproximativ 0,03 cazuri / 1000 ani-pacient, cu aproximativ 0,015 cazuri fatale / 1000 pacient-ani). În mai mult de 20.000 de ani de pacienți expunerea la metformină în studiile clinice, nu a fost raportată acidoză lactică. Cazurile raportate au apărut în principal la pacienții diabetici cu insuficiență renală semnificativă, incluzând atât cele renale intrinseci boală și hipoperfuzie renală, adesea în stabilirea unor probleme medicale / chirurgicale concomitente multiple și concomitente multiple medicamente. Pacienții cu insuficiență cardiacă congestivă care necesită un tratament farmacologic, în special cei cu instabilitate sau insuficiența cardiacă acută congestivă, care prezintă risc de hipoperfuzie și hipoxemie, prezintă un risc crescut de lactice acidoza. Riscul de acidoză lactică crește odată cu gradul de disfuncție renală și vârsta pacientului. Prin urmare, riscul de acidoză lactică poate fi scăzut semnificativ prin monitorizarea periodică a funcției renale în pacienții care iau Glucophage sau Glucophage XR și folosind doza minimă eficientă de Glucophage sau Glucophage XR. În special, tratamentul vârstnicilor trebuie să fie însoțit de o monitorizare atentă a funcției renale. Tratamentul cu Glucophage sau Glucophage XR nu trebuie inițiat la pacienții cu vârsta de 80 de ani, cu excepția măsurării creatininei clearance-ul demonstrează că funcția renală nu este redusă, deoarece acești pacienți sunt mai susceptibili de a dezvolta lactici acidoza. În plus, Glucophage și Glucophage XR trebuie reținute prompt în prezența oricărei afecțiuni asociate cu hipoxemie, deshidratare sau sepsis. Deoarece funcția hepatică afectată poate limita semnificativ capacitatea de a curăța lactatul, Glucofagul și Glucophage XR trebuie evitat, în general, la pacienții cu dovezi clinice sau de laborator hepatice boală. Pacienții trebuie avertizați împotriva consumului excesiv de alcool, acut sau cronic, atunci când iau Glucophage sau Glucophage XR, deoarece alcoolul potențează efectele clorhidratului de metformină asupra lactatului metabolism. În plus, Glucophage și Glucophage XR trebuie întrerupte temporar înainte de orice studiu de radiocontrast intravascular și pentru orice procedură chirurgicală (vezi de asemenea PRECAUȚII).
Debutul acidozei lactice este adesea subtil și însoțit doar de simptome nespecifice, cum ar fi starea de rău, mialgii, detresă respiratorie, somnolență și durere abdominală nespecifică. Pot fi asociate hipotermie, hipotensiune arterială și bradiriotmii rezistente cu acidoză mai marcată. Pacientul și medicul pacientului trebuie să fie conștienți de importanța posibilă a unor astfel de simptome, iar pacientul trebuie să fie instruit să notifice imediat medicul, dacă acestea apar (a se vedea de asemenea PRECAUȚII). Glucophage și Glucophage XR ar trebui să fie retrase până la clarificarea situației. Electroliți serici, cetone, glucoză din sânge și, dacă este indicat, pot fi utile pH-ul sângelui, nivelul lactatului și chiar nivelul metforminei din sânge. Odată ce un pacient este stabilizat la orice nivel de doză de Glucophage sau Glucophage XR, este puțin probabil ca simptomele gastrointestinale să fie frecvente în timpul inițierii terapiei. Apariția ulterioară a simptomelor gastro-intestinale s-ar putea datora acidozei lactice sau altei boli grave.
Nivelurile de lactat plasmatic venos în condiții de depășire a limitei superioare a normalului, dar sub 5 mmol / L la pacienții care iau Glucophage sau Glucophage XR nu indică neapărat acidoză lactică iminentă și poate fi explicată prin alte mecanisme, cum ar fi diabetul sau obezitatea slab controlate, activitatea fizică viguroasă sau problemele tehnice din eșantion manipulare. (Vezi si PRECAUȚII.)
Acidoza lactică trebuie suspectată la orice pacient diabetic cu acidoză metabolică lipsită de dovezi de cetoacidoză (ketonurie și ketonemie).
Acidoza lactică este o urgență medicală care trebuie tratată într-un cadru spitalicesc. La un pacient cu acidoză lactică care ia Glucophage sau Glucophage XR, medicamentul trebuie întrerupt imediat și se instituie imediat măsuri generale de susținere. Deoarece clorhidratul de metformin este dializabil (cu un clearance de până la 170 ml / min sub o hemodinamică bună condiții), se recomandă hemodializă promptă pentru a corecta acidoza și a elimina acumulatul metformină. Un astfel de management duce adesea la o inversare promptă a simptomelor și recuperare. (Vezi si CONTRAINDICAȚII și PRECAUȚII.)
top
Măsuri de precauție
General
Rezultate macrovasculare - Nu au existat studii clinice care să stabilească dovezi concludente privind reducerea riscului macrovascular cu Glucophage sau Glucophage XR sau cu orice alt medicament antidiabetic.
Monitorizarea funcției renale - Metformin este cunoscut a fi substanțial excretat de către rinichi și riscul acumulării de metformină și a acidozei lactice crește odată cu gradul de afectare renală funcţie. Astfel, pacienții cu niveluri de creatinină serică peste limita superioară a vârstei normale nu trebuie să primească Glucophage sau Glucophage XR. La pacienții cu vârsta înaintată, Glucophage și Glucophage XR trebuie să fie titrați cu atenție pentru a se stabili doza minimă pentru un efect glicemic adecvat, deoarece îmbătrânirea este asociată cu reducerea renală funcţie. La pacienții vârstnici, în special cei cu vârsta de 80 de ani, funcția renală trebuie monitorizată în mod regulat și, în general, Glucophage și Glucophage XR nu trebuie titrate la doza maximă (vezi AVERTIZĂRI și DOZAJ SI ADMINISTRARE).
Înainte de inițierea terapiei cu Glucophage sau Glucophage XR și cel puțin anual după aceea, funcția renală trebuie evaluată și verificată ca fiind normală. La pacienții la care este prevăzută dezvoltarea unei disfuncții renale, trebuie evaluată funcția renală mai frecvent și Glucophage sau Glucophage XR au fost întrerupte dacă există dovezi de insuficiență renală prezent.
Utilizarea medicamentelor concomitente care pot afecta funcția renală sau dispoziția metforminei - Medicamente (medicamente) concomitente care pot afecta funcția renală sau pot avea ca rezultat modificare hemodinamică semnificativă sau poate interfera cu dispoziția metforminei, cum ar fi medicamentele cationice care sunt eliminate prin secreția tubulară renală (vezi PRECAUȚII: Interacțiuni medicamentoase), trebuie utilizat cu precauție.
Studii radiologice care implică utilizarea de materiale de contrast intravasculare iodate (de exemplu, urograma intravenoasă, intravenoasă colangiografie, angiografie și tomografii computerizate (tomografii computerizate) cu materiale de contrast intravasculare) - Studii de contrast intravascular cu materialele iodate pot duce la alterarea acută a funcției renale și au fost asociate cu acidoza lactică la pacienții care primesc metformină (vezi CONTRAINDICAȚII). Prin urmare, la pacienții la care este planificat un astfel de studiu, Glucophage sau Glucophage XR trebuie întrerupte temporar la momentul sau înainte de procedură și reținută timp de 48 de ore ulterior procedurii și reinstituită numai după ce funcția renală a fost reevaluată și s-a dovedit a fi normal.
Stări hipoxice - colaps cardiovascular (șoc) din orice cauză, insuficiență cardiacă congestivă acută, miocardic acut infarctul și alte afecțiuni caracterizate prin hipoxemie au fost asociate cu acidoza lactică și pot provoca, de asemenea azotemie prerenală. Când astfel de evenimente au loc la pacienții tratați cu Glucophage sau Glucophage XR, medicamentul trebuie întrerupt imediat.
Proceduri chirurgicale - Terapia cu Glucophage sau Glucophage XR trebuie suspendată temporar pentru orice procedură chirurgicală (cu excepția procedurilor minore care nu sunt asociate cu aport limitat de alimente și lichide) și nu trebuie repornită până când reluarea administrării orale a pacientului și funcția renală a fost evaluată ca normal.
Aportul de alcool - Se știe că alcoolul potențează efectul metforminei asupra metabolismului lactatului. Prin urmare, pacienții trebuie avertizați împotriva consumului excesiv de alcool, acut sau cronic, în timp ce primesc Glucophage sau Glucophage XR.
Funcție hepatică afectată - Deoarece funcția hepatică afectată a fost asociată cu unele cazuri de acidoză lactică, Glucophage și Glucophage XR trebuie evitate, în general, la pacienții cu dovezi hepatice clinice sau de laborator boală.
Niveluri de vitamina B12 - În studiile clinice controlate cu Glucophage cu o durată de 29 de săptămâni, scăderea nivelurilor subnormale nivelurile anterioare normale de vitamina B12, fără manifestări clinice, au fost observate la aproximativ 7% din pacienți. O astfel de scădere, posibilă datorită interferenței cu absorbția B12 din complexul de factori intrinseci B12, este totuși foarte mare rareori asociate cu anemie și par a fi repede reversibile cu întreruperea Glucofagului sau a vitaminei B12 suplimentarea. Măsurarea parametrilor hematologici anual se recomandă la pacienții cu Glucophage sau Glucophage XR și orice anomalii aparente trebuie investigate și gestionate în mod corespunzător (vezi PRECAUȚII: Teste de laborator).
Anumiți indivizi (cei cu insuficiență de vitamina B12 sau aport de calciu sau absorbție) par a fi predispuși să dezvolte niveluri subnormale de vitamina B12. La acești pacienți, pot fi utile măsurători de vitamina B12 serice la intervale de 2 - 3 ani.
Schimbarea stării clinice a pacienților cu diabet zaharat de tip 2 controlat anterior - Un pacient cu diabet de tip 2 controlat anterior cu Glucophage sau Glucophage XR care dezvoltă anomalii de laborator sau boală clinică (în special boala vagă și slab definită) trebuie evaluată prompt pentru dovezi de cetoacidoză sau lactică acidoza. Evaluarea trebuie să includă electroliți și cetone serice, glicemie și, dacă este indicat, pH-ul sângelui, lactat, piruvat și metformină. Dacă apare acidoză de oricare dintre forme, Glucophage sau Glucophage XR trebuie oprite imediat și inițiate alte măsuri corective adecvate (vezi de asemenea AVERTIZĂRI).
Hipoglicemie - Hipoglicemia nu apare la pacienții care primesc Glucophage sau Glucophage XR singur în circumstanțele obișnuite de utilizare, dar ar putea apărea atunci când aportul caloric este deficiente, atunci când exercițiul intens nu este compensat prin suplimentarea calorică sau în timpul utilizării concomitente cu alți agenți de scădere a glucozei (cum ar fi sulfonilureele și insulina) sau etanol.
Pacienții vârstnici, debilitați sau subnutriți, precum și cei cu insuficiență suprarenală sau hipofizară sau intoxicații cu alcool sunt în special susceptibili la efecte hipoglicemice. Hipoglicemia poate fi dificil de recunoscut la vârstnici și la persoanele care iau medicamente blocante beta-adrenergice.
Pierderea controlului glucozei din sânge - Atunci când un pacient stabilizat la orice regim diabetic este expus la stres, cum ar fi febră, traume, infecții sau chirurgie, poate apărea o pierdere temporară a controlului glicemic. În astfel de momente, poate fi necesar să rețină Glucophage sau Glucophage XR și să administrezi temporar insulină. Glucophage sau Glucophage XR pot fi reinstituite după rezolvarea episodului acut.
Eficiența medicamentelor antidiabetice orale în scăderea glicemiei la un nivel țintit scade la mulți pacienți într-o perioadă de timp. Acest fenomen, care se poate datora progresiei bolii de baza sau a gradului de reacție diminuat la medicament, este cunoscut sub numele de eșec secundar, pentru a-l distinge de eșecul primar în care medicamentul este ineficient în timpul terapiei inițiale. Dacă apare un eșec secundar fie cu Glucophage, fie cu Glucophage XR sau cu monoterapie cu sulfonilurea, terapia combinată cu Glucophage sau Glucophage XR și sulfonilurea poate duce la un răspuns. În caz de eșec secundar, cu terapia combinată cu Glucophage / sulfonylurea sau Glucophage Terapia cu XR / sulfonilurea, poate fi necesară luarea în considerare a alternativelor terapeutice, inclusiv inițierea insulinoterapie.
Informații pentru pacienți
Pacienții trebuie informați despre riscurile și beneficiile potențiale ale Glucophage sau Glucophage XR și despre modurile alternative de terapie. De asemenea, aceștia trebuie informați despre importanța respectării instrucțiunilor dietetice, a unui exercițiu regulat program, și de testare regulată a glicemiei, a hemoglobinei glicozilate, a funcției renale și hematologice parametrii.
Riscurile acidozei lactice, a simptomelor sale și a condițiilor care predispun la dezvoltarea acesteia, așa cum s-a menționat în AVERTIZĂRI și PRECAUȚII secțiuni, trebuie explicate pacienților. Pacienții trebuie sfătuiți să întrerupă imediat Glucophage sau Glucophage XR și să-și notifice prompt sănătatea practicant dacă există hiperventilație inexplicabilă, mialgie, stare de rău, somnolență neobișnuită sau alte simptome nespecifice apar. Odată ce un pacient este stabilizat la orice nivel de doză de Glucophage sau Glucophage XR, este puțin probabil ca simptomele gastrointestinale să fie frecvente în timpul inițierii terapiei cu metformină. Apariția ulterioară a simptomelor gastro-intestinale s-ar putea datora acidozei lactice sau altei boli grave.
Pacienții trebuie sfătuiți împotriva consumului excesiv de alcool, fie acut, fie cronic, în timp ce primesc Glucophage sau Glucophage XR.
Glucophage sau Glucophage XR singure nu cauzează de obicei hipoglicemie, deși poate apărea atunci când Glucophage sau Glucophage XR sunt utilizate împreună cu sulfoniluree orale și insulină. La inițierea terapiei combinate, riscurile de hipoglicemie, simptomele și tratamentul acesteia și condițiile care predispun la dezvoltarea sa ar trebui explicate pacienților și familiei responsabile membri.
Pacienții trebuie informați că Glucophage XR trebuie înghițit integral și nu zdrobit sau mestecat și că ingredientele inactive pot fi ocazional eliminate în materiile fecale ca o masă moale care se poate asemăna cu originalul comprimat.
Teste de laborator
Răspunsul la toate terapiile diabetice trebuie monitorizat prin măsurători periodice ale sângelui în post niveluri de glucoză și hemoglobină glicozilată, cu scopul de a scădea aceste niveluri spre normal gamă. În timpul titrării inițiale a dozei, glucoza de post poate fi utilizată pentru a determina răspunsul terapeutic. După aceea, atât glucoza, cât și hemoglobina glicozilată trebuie monitorizate. Măsurătorile hemoglobinei glicozilate pot fi utile în special pentru evaluarea controlului pe termen lung (vezi de asemenea DOZAJ SI ADMINISTRARE).
Monitorizarea inițială și periodică a parametrilor hematologici (de exemplu, hemoglobină / hematocrit și sânge roșu indicii celulari) și funcția renală (creatinină serică) ar trebui să fie efectuate, cel puțin anual. În timp ce megaloblasticanemia a fost rareori observată cu terapia cu Glucofag, dacă se suspectează acest lucru, deficitul de vitamina B12 ar trebui exclus.
Interacțiunile medicamentoase (evaluarea clinică a interacțiunilor medicamentoase efectuate cu Glucofag)
Glyburide - într-un studiu de interacțiune cu o singură doză la pacienții cu diabet de tip 2, administrarea concomitentă a metformin și glicurură nu au dus la nici o schimbare în farmacocinetica metforminei sau farmacodinamie. S-au observat scăderi ale ASC și ale Cmax-ului gliburide, dar au fost extrem de variabile. Natura cu o singură doză a acestui studiu și lipsa corelației dintre nivelurile de sânge ale glicarburilor și efectele farmacodinamice, fac ca semnificația clinică a acestei interacțiuni să fie incertă (vezi DOZAJ SI ADMINISTRARE: Glucophage concomitent sau Glucophage XR și terapie orală cu sulfonilurea la pacienții adulți).
Furosemidă - Un studiu de interacțiune cu o singură doză, metformin-furosemidă la pacienții sănătoși a demonstrat că parametrii farmacocinetici ai ambilor compuși au fost afectați de administrarea concomitentă. Furosemida a crescut plasma de metformină și Cmax în sânge cu 22% și ASC în sânge cu 15%, fără nicio modificare semnificativă a clearance-ului renal al metforminei. Când au fost administrate cu metformină, Cmax și ASC furosemidă au fost cu 31% și, respectiv, 12% mai mici decât atunci când administrat singur, iar timpul de înjumătățire plasmatică final a fost redus cu 32%, fără o modificare semnificativă a furosemidului renal clearance-ul. Nu sunt disponibile informații despre interacțiunea metforminei și furosemidului atunci când au fost administrate în mod cronic.
Nifedipina - Un studiu de interacțiune cu o singură doză, metformin-nifedipină la voluntari sănătoși normali a demonstrat că administrarea concomitentă a nifedipinei a crescut cu 20% și cu 9% metformina plasmatică și ASC și a crescut cantitatea excretat în urină. Tmaxul și timpul de înjumătățire nu au fost afectate. Nifedipina pare să îmbunătățească absorbția metforminei. Metformin a avut efecte minime asupra nifedipinei.
Medicamente cationice - Medicamente cationice (de exemplu, amiloride, digoxină, morfină, procainamidă, chinidină, chinină, ranitidină, triamteren, trimetoprim sau vancomicină) care sunt eliminate prin secreția tubulară renală au, teoretic, potențialul interacțiunii cu metformina, concurand pentru transportul tubular renal comun sisteme. O astfel de interacțiune între metformin și cimetidină orală a fost observată la voluntarii sănătoși normali, atât în doză unică, cât și în doză multiplă, metformin-cimetidină studii de interacțiune medicamentoasă, cu o creștere de 60% a concentrației plasmatice de metformină maximă și a concentrațiilor de sânge integral și o creștere de 40% a plasmei și a metforminei din sânge întreg ASC. În studiul cu o singură doză nu a existat nicio schimbare în timpul de înjumătățire prin eliminare. Metformin nu a avut niciun efect asupra farmacocineticii cimetidinei. Deși aceste interacțiuni rămân teoretice (cu excepția cimetidinei), monitorizarea atentă a pacientului și ajustarea dozei de Glucophage sau Glucophage XR și / sau medicamentul interferent este recomandat la pacienții care iau medicamente cationice care sunt excretate prin secretorii tubulari renali proximali sistem.
Altele - Anumite medicamente tind să producă hiperglicemie și pot duce la pierderea controlului glicemic. Aceste medicamente includ tiazidele și alte diuretice, corticosteroizi, fenotiazine, produse tiroidiene, estrogeni, contraceptive orale, fenitoină, acid nicotinic, simpatomimetice, medicamente care blochează canalul de calciu și izoniazida. Când astfel de medicamente sunt administrate unui pacient care primește Glucophage sau Glucophage XR, pacientul trebuie să fie atent observat pentru pierderea controlului glucozei din sânge. Când aceste medicamente sunt retrase de la un pacient care primește Glucophage sau Glucophage XR, pacientul trebuie observat îndeaproape pentru hipoglicemie.
La voluntarii sănătoși, farmacocinetica metforminei și propranololului și a metforminei și ibuprofenului nu au fost afectate atunci când au fost administrate concomitent în studiile de interacțiune cu o singură doză.
Metformina este legată în mod neglijabil de proteinele plasmatice și, prin urmare, este mai puțin probabilă să interacționeze cu medicamente cu legături ridicate de proteine, cum ar fi salicilați, sulfonamide, cloramfenicol și probenecid, în comparație cu sulfonilureele, care sunt legate în mare măsură de ser proteine.
Carcinogeneza, mutageneza, afectarea fertilitatii
Studii de carcinogenitate pe termen lung au fost efectuate la șobolani (durata de administrare a 104 săptămâni) și șoareci (durata de administrare a 91 săptămâni) în doze de până la 900 mg / kg / zi și 1500 mg / kg / zi, inclusiv respectiv. Aceste doze sunt de aproximativ 4 ori mai mari decât doza zilnică maximă recomandată umană de 2000 mg pe baza comparațiilor cu suprafața corpului. Nu s-au găsit dovezi de carcinogenitate cu metformină la șoarecii de sex masculin sau feminin. În mod similar, la șobolanii de sex masculin nu s-a observat potențial tumorogenic cu metformină. Cu toate acestea, a existat o incidență crescută de polipi uterini benigni stromali la șobolani de sex feminin tratate cu 900 mg / kg / zi.
Nu a existat nicio dovadă a unui potențial mutagen al metforminei în următoarele teste in vitro: Test Ames (S. tifimuriu), test de mutație a genelor (celule de limfom de șoarece) sau test de aberații cromozomiale (limfocite umane). Rezultatele testului in vivo al micronucleului la șoarece au fost, de asemenea, negative.
Fertilitatea șobolanilor de sex masculin sau feminin nu a fost afectată de metformină atunci când a fost administrată în doze de până la 600 mg / kg / zi, care este de aproximativ 3 ori mai mare decât doza zilnică maximă recomandată de om pe baza suprafeței corpului comparații.
graviditate
Efecte teratogene: categoria B a sarcinii
Informații recente sugerează cu tărie că nivelurile anormale ale glicemiei în timpul sarcinii sunt asociate cu o incidență mai mare a anomaliilor congenitale. Majoritatea experților recomandă utilizarea insulinei în timpul sarcinii pentru a menține nivelul glicemiei cât mai aproape de normal. Deoarece studiile asupra reproducerii la animale nu sunt întotdeauna predictive pentru răspunsul uman, Glucophage și Glucophage XR nu trebuie utilizate în timpul sarcinii, decât dacă este necesar.
Nu există studii adecvate și bine controlate la gravide cu Glucophage sau Glucophage XR. Metformina nu a fost teratogenă la șobolani și iepuri la doze de până la 600 mg / kg / zi. Aceasta reprezintă o expunere de aproximativ 2 și 6 ori mai mare decât doza zilnică recomandată umană de 2000 mg pe baza comparațiilor suprafeței corporale pentru șobolani și, respectiv, iepuri. Determinarea concentrațiilor fetale a demonstrat o barieră placentară parțială la metformină.
Mamele care alăptează
Studiile la șobolani care alăptează arată că metformina este excretată în lapte și atinge nivele comparabile cu cele din plasmă. Studii similare nu au fost efectuate la mame care alăptează. Deoarece există potențial de hipoglicemie la sugarii care trebuie să alăpteze, ar trebui să se ia decizia dacă întrerupeți asistența medicală sau întrerupeți medicamentul, ținând cont de importanța medicamentului pentru medicamente mamă. În cazul în care Glucophage sau Glucophage XR este întreruptă și în cazul în care dieta singură este inadecvată pentru controlul glicemiei, trebuie luată în considerare terapia cu insulină.
Utilizare pediatrică
Siguranța și eficacitatea Glucofagului pentru tratamentul diabetului de tip 2 au fost stabilite în pacienți pediatrici cu vârsta cuprinsă între 10 și 16 ani (nu au fost efectuate studii la pacienți pediatri cu vârsta sub 10 ani ani). Utilizarea Glucophage la această grupă de vârstă este susținută de dovezi provenite din studii adecvate și bine controlate asupra Glucophage la adulți, cu date suplimentare de la studiu clinic controlat la pacienți pediatri cu vârste cuprinse între 10 și 16 ani cu diabet zaharat tip 2, care a demonstrat un răspuns similar în controlul glicemic la cel observat în adulți. (Vedea FARMACOLOGIE CLINICĂ: Studii clinice pediatrice.) În acest studiu, efectele adverse au fost similare cu cele descrise la adulți. (Vedea REACTII ADVERSE: Pacienți pediatri.) Este recomandată o doză maximă zilnică de 2000 mg. (Vedea DOZAJ SI ADMINISTRARE: Program de dozare recomandat: pediatrie.)
Nu a fost stabilită siguranța și eficacitatea Glucophage XR la pacienții pediatri.
Utilizare geriatrică
Studiile clinice controlate asupra Glucophage și Glucophage XR nu au inclus un număr suficient de pacienți vârstnici pentru a determina dacă răspund diferit de pacienții mai tineri, deși alte experiențe clinice raportate nu au identificat diferențe de răspuns între vârstnici și tineri pacienți. Metformin este cunoscut a fi substanțial excretat de către rinichi și deoarece riscul de reacții adverse grave la medicament este mai mare la pacienții cu funcție renală afectată, Glucophage și Glucophage XR trebuie utilizate numai la pacienții cu funcție renală normală (vezi CONTRAINDICAȚII, AVERTIZĂRI, și FARMACOLOGIE CLINICĂ: Farmacocinetică). Deoarece îmbătrânirea este asociată cu funcția renală redusă, Glucophage sau Glucophage XR trebuie utilizate cu precauție pe măsură ce vârsta crește. Trebuie avut grijă în selectarea dozei și trebuie să se bazeze pe o monitorizare atentă și regulată a funcției renale. În general, pacienții vârstnici nu trebuie titrați la doza maximă de Glucophage sau Glucophage XR (vezi de asemenea AVERTIZĂRI și DOZAJ SI ADMINISTRARE).
top
Reactii adverse
Într-un studiu clinic dublu-orb din Statele Unite ale Glucophage la pacienții cu diabet zaharat tip 2, un total de 141 de pacienți au primit terapia cu Glucophage (până la 2550 mg pe zi) și 145 de pacienți au primit placebo. În tabelul 11 sunt enumerate reacțiile adverse raportate la mai mult de 5% dintre pacienții cu Glucophage și care au fost mai frecvente la pacienții tratati cu Glucophage decât în cazul tratamentului cu placebo.
Tabelul 11: Cele mai frecvente reacții adverse (> 5,0 procente) într-un studiu clinic controlat cu placebo al monoterapiei cu glucofag *
| Reacție adversă | Glucophage Monoterapie (N = 141) |
placebo (N = 145) |
|---|---|---|
| % dintre pacienți | ||
| * Reacții care au fost mai frecvente la Glucofag decât la pacienții tratați cu placebo. | ||
| Diaree | 53.2 | 11.7 |
| Greață / vărsături | 25.5 | 8.3 |
| meteorism | 12.1 | 5.5 |
| Astenie | 9.2 | 5.5 |
| Indigestie | 7.1 | 4.1 |
| Disconfort abdominal | 6.4 | 4.8 |
| Durere de cap | 5.7 | 4.8 |
Diareea a dus la întreruperea medicației de studiu la 6% dintre pacienții tratați cu Glucofag. În plus, următoarele reacții adverse au fost raportate la 1.0 ¥ 1,0% la 5,5% dintre pacienții cu Glucophage și au fost mai frecvent raportate cu Glucophage decât cu placebo: scaune anormale, hipoglicemie, mialgie, vârf de lumină, dispnee, tulburări de unghii, erupții cutanate, transpirație crescută, tulburări de gust, disconfort toracic, frisoane, sindrom de gripă, înroșire, palpitatii.
În studiile clinice la nivel mondial, peste 900 de pacienți cu diabet zaharat de tip 2 au fost tratați cu Glucophage XR în studii placebo și controlate activ. În studiile controlate cu placebo, 781 de pacienți au fost administrați Glucophage XR și 195 de pacienți au primit placebo. În tabelul 12 sunt enumerate reacțiile adverse raportate la mai mult de 5% dintre pacienții cu Glucophage XR și care au fost mai frecvente la Glucophage XR decât la pacienții tratați cu placebo.
Tabelul 12: Cele mai frecvente reacții adverse (> 5,0 procente) în studiile controlate cu placebo asupra Glucophage XR *
| Reacție adversă | Glucofag XR (N = 781) |
placebo (N = 195) |
|---|---|---|
| % dintre pacienți | ||
| * Reacții care au fost mai frecvente la Glucophage XR decât la pacienții tratați cu placebo. | ||
| Diaree | 9.6 | 2.6 |
| Greață / vărsături | 6.5 | 1.5 |
Diareea a dus la întreruperea medicației de studiu la 0,6% dintre pacienții tratați cu Glucophage XR. În plus, următoarele reacții adverse au fost raportate la 1.0 ¥ 1,0% la â5,0% dintre pacienții cu Glucophage XR și au fost mai frecvent raportate cu Glucophage XR decât placebo: dureri abdominale, constipație, abdomen de distensie, dispepsie / arsuri la stomac, flatulență, amețeli, cefalee, infecție respiratorie superioară, gust tulburări.
Pacienți pediatri
În studiile clinice cu Glucophage la pacienții pediatri cu diabet zaharat tip 2, profilul reacțiilor adverse a fost similar celui observat la adulți.
top
Supradozaj
S-a produs supradozaj de clorhidrat de metformină, inclusiv ingestia unor cantități mai mari de 50 de grame. Hipoglicemia a fost raportată în aproximativ 10% din cazuri, dar nu s-a stabilit nicio asociere cauzală cu clorhidratul de metformină. Acidoza lactică a fost raportată la aproximativ 32% din cazurile de supradozaj cu metformină (vezi AVERTIZĂRI). Metformina este dializabilă cu un clearance de până la 170 ml / min în condiții bune hemodinamice. Prin urmare, hemodializa poate fi utilă pentru îndepărtarea medicamentului acumulat de la pacienții la care este suspectată supradozajul cu metformină.
top
Dozaj si administrare
Nu există un regim de dozare fixă pentru tratamentul hiperglicemiei la pacienții cu diabet zaharat tip 2 cu Glucophage sau Glucophage XR sau cu orice alt agent farmacologic. Doza de Glucophage sau Glucophage XR trebuie individualizată atât pe baza eficienței, cât și a toleranței, fără a depăși dozele maxime recomandate zilnic. Doza maximă recomandată zilnic de Glucofag este de 2550 mg la adulți și de 2000 mg la pacienții pediatri (10-16 ani); doza maximă recomandată zilnic de Glucophage XR la adulți este de 2000 mg.
Glucofagul trebuie administrat în doze divizate cu mese, în timp ce Glucophage XR, în general, trebuie administrat o dată pe zi, cu masa de seară. Glucophage sau Glucophage XR trebuie început cu o doză mică, cu escaladarea treptată a dozei, ambele pentru a reduce reacții adverse gastrointestinale și să permită identificarea dozei minime necesare pentru un control glicemic adecvat a pacientului.
În timpul inițierii tratamentului și a titrării dozei (a se vedea Programul de dozare recomandat mai jos), trebuie să se administreze glucoză în plasmă utilizat pentru a determina răspunsul terapeutic la Glucophage sau Glucophage XR și a identifica doza minimă eficientă pentru rabdator. După aceea, hemoglobina glicozilată trebuie măsurată la intervale de aproximativ 3 luni. Scopul terapeutic ar trebui să fie reducerea nivelului de glucoză plasmatică în condiții de jeun și a hemoglobinei glicozilate la normal sau aproape normal de folosind cea mai mică doză eficientă de Glucophage sau Glucophage XR, fie atunci când este utilizat ca monoterapie sau în combinație cu sulfonilurea sau insulină.
Monitorizarea glicemiei și a hemoglobinei glicozilate va permite, de asemenea, detectarea eșecului primar, adică scăderea inadecvată a glicemiei la doza maximă recomandată de medicamente și eșecul secundar, adică pierderea unui răspuns adecvat de scădere a glicemiei după o perioadă inițială de eficacitate.
Administrarea pe termen scurt a Glucophage sau Glucophage XR poate fi suficientă în perioadele de pierdere tranzitorie a controlului la pacienții, de regulă, bine controlați numai pe dieta.
Comprimatele Glucophage XR trebuie înghițite întregi și niciodată zdrobite sau mestecate. Ocazional, ingredientele inactive ale Glucophage XR vor fi eliminate în materiile fecale sub formă de masă moale, hidratată.
Program recomandat de dozare
Adulți
În general, răspunsurile semnificative din punct de vedere clinic nu sunt observate la doze sub 1500 mg pe zi. Cu toate acestea, se recomandă o doză inițială mai mică recomandată și o doză crescută treptat pentru a reduce la minimum simptomele gastro-intestinale.
Doza inițială obișnuită de Glucophage (clorhidrat de metformin) este de 500 mg de două ori pe zi sau de 850 mg o dată pe zi, administrate împreună cu mese. Creșterile dozelor trebuie făcute în pași de 500 mg săptămânal sau 850 mg la fiecare 2 săptămâni, până la un total de 2000 mg pe zi, administrate în doze divizate. De asemenea, pacienții pot fi titrați de la 500 mg de două ori pe zi la 850 mg de două ori pe zi, după 2 săptămâni. Pentru acei pacienți care necesită un control glicemic suplimentar, Glucophage poate fi administrat la o doză maximă zilnică de 2550 mg pe zi. Dozele peste 2000 mg pot fi mai bine tolerate, administrate de 3 ori pe zi, împreună cu mesele.
Doza inițială obișnuită de Glucophage XR (metformin clorhidrat) comprimate cu eliberare prelungită este de 500 mg o dată pe zi, cu masa de seară. Creșterile dozelor trebuie făcute în pași de 500 mg săptămânal, până la maximum 2000 mg o dată pe zi cu masa de seară. Dacă nu se obține controlul glicemic pe Glucophage XR 2000 mg o dată pe zi, trebuie avut în vedere un studiu cu Glucophage XR 1000 mg de două ori pe zi. Dacă sunt necesare doze mai mari de metformină, Glucophage trebuie utilizat la doze zilnice totale de până la 2550 mg administrate în doze zilnice divizate, așa cum este descris mai sus. (Vedea FARMACOLOGIE CLINICĂ: Studii clinice.)
Într-un studiu randomizat, pacienții tratați în prezent cu Glucophage au fost comutați la Glucophage XR. Rezultatele acestui studiu sugerează că pacienții care primesc tratament cu Glucophage pot fi schimbați în siguranță la Glucophage XR o dată pe zi, în aceeași doză zilnică totală, până la 2000 mg o dată pe zi. După trecerea de la Glucophage la Glucophage XR, controlul glicemic trebuie monitorizat îndeaproape și ajustările dozajului trebuie efectuate în consecință (vezi FARMACOLOGIE CLINICĂ: Studii clinice).
Pediatrie
Doza inițială obișnuită de Glucofag este de 500 mg de două ori pe zi, administrată împreună cu mese. Creșterile dozelor trebuie făcute în pași de 500 mg săptămânal până la maximum 2000 mg pe zi, administrate în doze divizate. Nu a fost stabilită siguranța și eficacitatea Glucophage XR la pacienții pediatri.
Transfer de la alte terapii antidiabetice
Atunci când transferați pacienți de la agenți hipoglicemici orali standard, altele decât clorpropamidă, la Glucophage sau Glucophage XR, nu este necesară în general o perioadă de tranziție. Atunci când transferați pacienții din clorpropamidă, trebuie acordată îngrijire în primele 2 săptămâni din cauza retenția prelungită a clorpropamidei în organism, ceea ce duce la suprapunerea efectelor medicamentoase și posibilă hipoglicemie.
Glucophage concomitent sau Glucophage XR și terapie orală cu sulfonilurea la pacienții adulți
Dacă pacienții nu au răspuns la 4 săptămâni de la doza maximă de monoterapie cu Glucophage sau Glucophage XR, trebuie luată în considerare adăugarea treptată a o sulfonilurea orală în timp ce continuă Glucophage sau Glucophage XR la doza maximă, chiar dacă eșecul primar sau secundar anterior al sulfonilureei are a avut loc. Datele clinice și farmacocinetice de interacțiune medicament-medicament sunt disponibile în prezent numai pentru metformină plus glicuridă (glibenclamidă).
Cu Glucophage sau Glucophage XR concomitent și terapie cu sulfonilurea, controlul dorit al glicemiei poate fi obținut prin ajustarea dozei fiecărui medicament. Într-un studiu clinic la pacienții cu diabet zaharat de tip 2 și eșec prealabil la glicuridă, pacienții au început cu Glucophage 500 mg și glicuridă 20 mg au fost titrați la 1000/20 mg, 1500/20 mg, 2000/20 mg sau, respectiv, 2500/20 mg Glucofag și, respectiv, glucbură, pentru a atinge obiectivul controlului glicemic măsurat prin FPG, HbA1c și răspunsul glucozei plasmatice (vedea FARMACOLOGIE CLINICĂ: Studii clinice). Cu toate acestea, ar trebui să se încerce identificarea dozei minime eficiente a fiecărui medicament pentru atingerea acestui obiectiv. Cu Glucophage sau Glucophage XR concomitent și terapie cu sulfonilurea, riscul de hipoglicemie asociat cu terapia cu sulfonilurea continuă și poate fi crescut. Trebuie luate măsuri de precauție adecvate. (Consultați Introducerea pachetului cu sulfonilurea respectivă.)
Dacă pacienții nu au răspuns satisfăcător la 1 - 3 luni de terapie concomitentă cu doza maximă de Glucophage sau Glucophage XR și doza maximă de sulfonilurea orală, ia în considerare alternativele terapeutice, inclusiv trecerea la insulină cu sau fără Glucophage sau Glucophage XR.
Glucofag concomitent sau Glucophage XR și insulinoterapie la pacienții adulți
Doza actuală de insulină trebuie continuată după inițierea tratamentului cu Glucophage sau Glucophage XR. Terapia cu Glucophage sau Glucophage XR trebuie inițiată la 500 mg o dată pe zi la pacienții tratați cu insulină. Pentru pacienții care nu răspund în mod adecvat, doza de Glucophage sau Glucophage XR trebuie crescută cu 500 mg după aproximativ 1 săptămână și cu 500 mg în fiecare săptămână după aceea, până la un control glicemic adecvat realizat. Doza zilnică maximă recomandată este de 2500 mg pentru Glucophage și 2000 mg pentru Glucophage XR. Se recomandă ca doza de insulină să fie scăzută cu 10% la 25% atunci când alimentați glucoza în plasmă concentrațiile scad la mai puțin de 120 mg / dL la pacienții care primesc concomitent insulină și Glucofag sau Glucofag XR. Ajustarea suplimentară trebuie individualizată pe baza răspunsului la scăderea glucozei.
Populații specifice pacientului
Glucophage sau Glucophage XR nu sunt recomandate pentru utilizare în sarcină. Glucofagul nu este recomandat la pacienții cu vârsta sub 10 ani. Glucophage XR nu este recomandat la pacienții pediatri (sub vârsta de 17 ani).
Dozarea inițială și de întreținere a Glucophage sau Glucophage XR trebuie să fie conservatoare la pacienții cu vârsta înaintată, datorită potențialului de scădere a funcției renale la această populație. Orice ajustare a dozei trebuie să se bazeze pe o evaluare atentă a funcției renale. În general, pacienții vârstnici, debilitați și subnutriți nu trebuie titrați la doza maximă de Glucophage sau Glucophage XR.
Monitorizarea funcției renale este necesară pentru a ajuta la prevenirea acidozei lactice, în special la vârstnici. (Vedea AVERTIZĂRI.)
top
Cât este furnizat
Tablete Glucophage® (clorhidrat de metformin)
| 500 mg | Sticle de 100 | NDC 0087-6060-05 |
| 500 mg | Sticle de 500 | NDC 0087-6060-10 |
| 850 mg | Sticle de 100 | NDC 0087-6070-05 |
| 1000 mg | Sticle de 100 | NDC 0087-6071-11 |
Comprimatele de 500 mg Glucophage sunt comprimate rotunde, de culoare albă până la alb-alb, filmate, cu „BMS” 6060 "în jurul periferiei tabletei pe o parte și" 500 "înfășurate pe fața celeilalte latură.
Comprimatele cu glucofag de 850 mg sunt comprimate rotunde, de culoare albă până la alb-alb, filmate, cu „BMS” 6070 "în jurul periferiei tabletei pe o parte și" 850 "înfășurată pe fața celeilalte latură.
Comprimatele de 1000 mg Glucofag sunt comprimate filmate albe, ovale, biconvexe, filmate cu „BMS 6071” înfășurate pe o parte și „1000” înfășurate pe partea opusă și cu o linie bisectă pe ambele părți.
Tablete cu eliberare extinsă Glucophage® XR (clorhidrat de metformină)
| 500 mg | Sticle de 100 | NDC 0087-6063-13 |
| 750 mg | Sticle de 100 | NDC 0087-6064-13 |
Comprimatele Glucophage XR 500 mg sunt comprimate biconvexe, de culoare albă până la alb-închisă, cu „BMS 6063” înfășurate pe o parte și „500” înfășurate pe fața celeilalte părți.
Comprimatele Glucophage XR 750 mg sunt comprimate biconvexe, în formă de capsulă, cu „BMS 6064” înfășurate pe o parte și „750”, pe cealaltă parte. Tabletele sunt de un roșu pal și pot avea un aspect macinat.
Depozitare
A se păstra la 20 ° -25 ° C (68 ° -77 ° F); excursii permise la 15 ° -30 ° C (59 ° -86 ° F). [Vezi temperatura camerei controlate USP.]
Se distribuie în containere rezistente la lumină.
Glucophage® este marcă comercială înregistrată a Merck Santà © S.A.S., un asociat al Merck KGaA din Darmstadt, Germania. Licențiat companiei Bristol-Myers Squibb.
Distribuit de:
Compania Bristol-Myers Squibb
Princeton, NJ 08543 SUA
ultima actualizare: 01/2009
Glucohage, clorhidrat de metformină, informații despre pacient (în engleză simplă)
Informații detaliate despre semne, simptome, cauze, tratamente ale diabetului
Informațiile din această monografie nu sunt destinate să acopere toate utilizările posibile, indicații, precauții, interacțiuni medicamentoase sau efecte adverse. Aceste informații sunt generalizate și nu sunt destinate ca sfaturi medicale specifice. Dacă aveți întrebări despre medicamentele pe care le luați sau doriți mai multe informații, consultați medicul, farmacistul sau asistenta medicală.
înapoi la: Căutați toate medicamentele pentru diabet


