Apidra pentru tratamentul diabetului
Nume de marcă: Apidra
Denumire generică: Insulina Glulisină
Apidra (insulina glulisină) este un produs fabricat de om aproape identic cu insulina umană. Este utilizat pentru a trata diabetul zaharat. Utilizare, dozare, reacții adverse.
Cuprins:
Indicații și utilizare
Dozaj si administrare
Contraindicații
Avertismente și precauții
Reactii adverse
Interacțiunile medicamentoase
Utilizare în populații specifice
Supradozarea
Descriere
Farmacologie clinică
Toxicologie nonclinică
Studii clinice
Cât este furnizat
Apidra, insulina glusină, informații despre pacient (în engleză simplă)
indicaţii
Apidra este un analog cu insulină umană cu acțiune rapidă indicat pentru a îmbunătăți controlul glicemic la adulți și copii cu diabet zaharat.
top
Dozaj si administrare
Considerații de dozare
APIDRA este un analog insulinic recombinant care este echipotent la insulina umană (adică o unitate de APIDRA are același efect de scădere a glucozei ca și o unitate de insulină umană obișnuită) atunci când este administrat intravenos. Când este administrat subcutanat, APIDRA are un debut mai rapid al acțiunii și o durată de acțiune mai scurtă decât insulina umană obișnuită.
Doza de APIDRA trebuie individualizată. Monitorizarea glicemiei este esențială la toți pacienții care primesc tratament cu insulină.
Necesarul zilnic total de insulină poate varia și este de obicei între 0,5 și 1 unitate / kg / zi. Cerințele de insulină pot fi modificate în timpul stresului, boli majore sau cu modificări ale exercițiului fizic, a regimului de masă sau a medicamentelor administrate în comun.
Administrare subcutanată
APIDRA trebuie administrat în 15 minute înainte de masă sau în 20 de minute de la începerea mesei.
APIDRA, administrat prin injecție subcutanată, trebuie utilizat în general în regimuri cu insulină cu acțiune intermediară sau cu acțiune lungă.
APIDRA trebuie administrat prin injecție subcutanată în peretele abdominal, coapsa sau brațul superior. Locurile de injecție trebuie rotite în aceeași regiune (abdomen, coapsă sau braț superior) de la o injecție la alta pentru a reduce riscul de lipodistrofie [Vezi REACTII ADVERSE].
Infuzie continuă subcutanată (pompă de insulină)
APIDRA poate fi administrat prin perfuzie subcutanată continuă în peretele abdominal. Nu folosiți insuline diluate sau mixte în pompele de insulină externe. Locurile de perfuzie trebuie rotite în aceeași regiune pentru a reduce riscul lipodistrofiei [Vezi REACTII ADVERSE]. Programarea inițială a pompei de perfuzie externă de insulină trebuie să se bazeze pe doza zilnică totală de insulină din regimul anterior.
Următoarele pompe de insulină au fost utilizate în studiile clinice APIDRA efectuate de sanofi-aventis, producătorul APIDRA:
- Disetronic® H-Tron® plus V100 și D-Tron® cu catetere Disetronic (Rapid ™, Rapid C ™, Rapid D ™ și Tender ™)
- Modelele MiniMed® 506, 507, 507c și 508 cu catetere MiniMed (Sof-set Ultimate QR ™ și Quick-set ™).
Înainte de a utiliza o pompă de insulină diferită cu APIDRA, citiți eticheta pompei pentru a vă asigura că pompa a fost evaluată cu APIDRA.
Medicii și pacienții ar trebui să evalueze cu atenție informațiile despre utilizarea pompei din APIDRA care prescriu informații, în prospectul informațiilor despre pacient și în manualul producătorului pompei. Informațiile specifice APIDRA ar trebui urmate pentru timpul de utilizare, frecvența schimbării seturilor de perfuzie sau altele detalii specifice utilizării APIDRA, deoarece informațiile specifice APIDRA pot diferi de manualul general al pompei instrucțiuni.
Pe baza studiilor in vitro care au arătat pierderea conservantului, metacresolului și degradării insulinei, APIDRA în rezervor trebuie modificată cel puțin la fiecare 48 de ore. APIDRA în uz clinic nu trebuie expus la temperaturi mai mari de 37 ° C (98,6 ° F). [Vedea AVERTIZĂRI ȘI PRECAUȚII și CUM SE FURNIZĂ / Depozitare și manipulare].
Administrare intravenoasă
APIDRA poate fi administrat intravenos sub supraveghere medicală pentru control glicemic, cu monitorizare atentă a glicemiei și a potasiului seric pentru a evita hipoglicemia și hipokalemia. Pentru utilizare intravenoasă, APIDRA trebuie utilizat la concentrații de 0,05 Unități / mL până la 1 Unitate / ml insulină glulisină în sistemele de perfuzie folosind pungi de clorură de polivinil (PVC). S-a dovedit că APIDRA este stabilă numai în soluție salină normală (0,9% clorură de sodiu). Produsele medicamentoase parenterale trebuie inspectate vizual pentru a se administra particule și decolorarea înainte de administrare, ori de câte ori soluția și recipientul o permit. Nu administrați amestecuri de insulină intravenos.
Forme de dozare și forțe
Apidra 100 de unități pe ml (U-100) este disponibil ca:
- Flacoane de 10 ml
- Cartușe de 3 ml pentru utilizare în OptiClik® Dispozitiv de livrare a insulinei
- Stilou preumpluit SoloStar de 3 ml
top
Contraindicații
Apidra este contraindicat:
- în timpul episoadelor de hipoglicemie
- la pacienții hipersensibili la Apidra sau la oricare dintre excipienții săi
Când se utilizează la pacienți cu hipersensibilitate cunoscută la Apidra sau excipienții săi, pacienții pot dezvolta reacții de hipersensibilitate localizate sau generalizate [Vezi Reactii adverse].
top
Avertismente și precauții
Reglare și monitorizare a dozajului
Monitorizarea glucozei este esențială pentru pacienții care primesc tratament cu insulină. Modificările unui regim de insulină trebuie făcute cu prudență și numai sub supraveghere medicală. Modificările de rezistență la insulină, producătorul, tipul sau metoda de administrare pot duce la necesitatea unei modificări a dozei de insulină. Poate fi necesar să fie ajustat tratamentul antidiabetic oral concomitent.
La fel ca în cazul tuturor preparatelor de insulină, timpul de acțiune pentru Apidra poate varia la diferiți indivizi sau în momente diferite în același individ și depinde de multe afecțiuni, inclusiv locul injecției, alimentarea locală de sânge sau local temperatura. Pacienții care își schimbă nivelul de activitate fizică sau planul mesei pot necesita ajustarea dozelor de insulină.
hipoglicemia
Hipoglicemia este cea mai frecventă reacție adversă a insulinoterapiei, inclusiv Apidra. Riscul de hipoglicemie crește odată cu un control glicemic mai strâns. Pacienții trebuie educați să recunoască și să gestioneze hipoglicemia. Hipoglicemia severă poate duce la inconștiență și / sau convulsii și poate duce la afectarea temporară sau permanentă a funcției creierului sau a decesului. Hipoglicemie severă care necesită asistența unei alte persoane și / sau infuzie parenterală de glucoză sau administrarea glucagonului a fost observată în studiile clinice cu insulină, inclusiv în studiile cu Apidra.
Momentul hipoglicemiei reflectă de obicei profilul de acțiune în timp al formulărilor de insulină administrate. Alți factori, cum ar fi modificările aportului alimentar (de exemplu, cantitatea de alimente sau momentul în care se află mesele), locul injecției, exercițiile fizice și medicamentele concomitente pot, de asemenea, modifica riscul de hipoglicemie [Vezi Interacțiunile medicamentoase].
Ca și în cazul tuturor insulinelor, utilizați prudență la pacienții cu hipoglicemie fără cunoștință și la pacienții care pot fi predispus la hipoglicemie (de exemplu, populația pediatrică și pacienții care postesc sau au mâncare neregulată admisie). Abilitatea pacientului de a se concentra și reacționa poate fi afectată ca urmare a hipoglicemiei. Acest lucru poate prezenta un risc în situații în care aceste abilități sunt deosebit de importante, cum ar fi conducerea sau exploatarea altor utilaje.
Modificările rapide ale nivelului de glucoză seric pot induce simptome similare hipoglicemiei la persoanele cu diabet, indiferent de valoarea glucozei. Simptomele de avertizare timpurie a hipoglicemiei pot fi diferite sau mai puțin pronunțate în anumite condiții, cum ar fi diabetul de lungă durată, boala nervilor diabetici, utilizarea de medicamente precum beta-blocante [Vezi Interacțiunile medicamentoase], sau intensificarea controlului diabetului. Aceste situații pot duce la hipoglicemie severă (și, posibil, la pierderea cunoștinței) înainte de conștientizarea pacientului despre hipoglicemie.
Insulina administrată intravenos are o acțiune mai rapidă decât insulina administrată subcutanat, necesitând o monitorizare mai atentă a hipoglicemiei.
Hipersensibilitate și reacții alergice
Alergii severe, care pot pune viața în viață, generalizate, inclusiv anafilaxia, pot apărea cu produse de insulină, inclusiv Apidra [Vezi Reactii adverse].
Hipopotasemia
Toate produsele de insulină, inclusiv Apidra, determină o schimbare a potasiului din spațiul extracelular în cel intracelular, ceea ce poate duce la hipokalemie. Hipokalemia netratată poate cauza paralizie respiratorie, aritmie ventriculară și deces. Aveți precauție la pacienții care pot fi expuși riscului de hipokalemie (de exemplu, pacienți care utilizează medicamente pentru reducerea potasiului, pacienți care iau medicamente sensibile la concentrații serice de potasiu). Monitorizați frecvent glucoza și potasiul atunci când Apidra este administrat intravenos.
Insuficiență renală sau hepatică
Poate fi necesară monitorizarea frecventă a glucozei și reducerea dozei de insulină la pacienții cu insuficiență renală sau hepatică [Vezi Farmacologie clinică].
Amestecarea insulinelor
Apidra pentru injecție subcutanată nu trebuie amestecat cu alte preparate de insulină decât insulina NPH. Dacă Apidra este amestecat cu insulină NPH, Apidra trebuie mai întâi introdus în seringă. Injecția trebuie să apară imediat după amestecare.
Nu amestecați Apidra cu alte insuline pentru administrare intravenoasă sau pentru utilizare într-o pompă de perfuzie subcutanată continuă.
Apidra pentru administrare intravenoasă nu trebuie diluată cu alte soluții decât 0,9% clorură de sodiu (soluție salină normală). Nu a fost stabilită eficacitatea și siguranța amestecării Apidra cu diluanți sau alte insuline pentru utilizarea în pompele de perfuzie subcutanate externe.
Pompe de perfuzie sub insulină de insulină
Atunci când este utilizat într-o pompă de insulină externă pentru infuzie subcutanată, Apidra nu trebuie diluat sau amestecat cu nicio altă insulină. Apidra din rezervor trebuie schimbată cel puțin la fiecare 48 de ore. Apidra nu trebuie să fie expus la temperaturi mai mari de 37 ° C (98,6 ° F).
Defecțiunea pompei de insulină sau setul de perfuzie sau degradarea insulinei poate duce rapid la hiperglicemie și cetoză. Identificarea și corectarea promptă a cauzei hiperglicemiei sau cetozei este necesară. Pot fi necesare injecții subcutanate intermediare cu Apidra. Pacienții care utilizează terapie continuă cu pompă cu insulină subcutanată trebuie să fie instruiți să administreze insulina prin injectare și să aibă disponibilă terapie cu insulină alternativă în caz de defectare a pompei. [Vedea Dozaj si administrare, Mod de furnizare / depozitare și manipulare].
Administrare intravenoasă
Atunci când Apidra este administrat intravenos, nivelurile de glucoză și potasiu trebuie monitorizate îndeaproape pentru a evita hipoglicemia și hipokalemia potențial fatale.
Nu amestecați Apidra cu alte insuline pentru administrare intravenoasă. Apidra poate fi diluată numai în soluție salină normală.
Interacțiunile medicamentoase
Unele medicamente pot modifica necesarul de insulină și riscul pentru hipoglicemie sau hiperglicemie [Vezi Interacțiunile medicamentoase].
top
Reactii adverse
Următoarele reacții adverse sunt discutate în altă parte:
- Hipoglicemie [Vezi Avertismente și precauții]
- Hipokalemie [Vezi Avertismente și precauții]
Experiență de studiu clinic
Deoarece studiile clinice sunt efectuate în conformitate cu modele variate, ratele de reacție adversă raportate într-un studiu clinic pot să nu să fie ușor comparate cu acele rate raportate într-un alt studiu clinic și nu pot reflecta ratele observate efectiv în clinică practică.
Frecvențele reacțiilor adverse la medicamente în timpul studiilor clinice cu Apidra la pacienții cu diabet zaharat tip 1 și diabet zaharat tip 2 sunt enumerate în tabelele de mai jos.
Tabelul 1: Reacții adverse la tratament la studii colectate la adulți cu diabet zaharat tip 1 (evenimente adverse cu frecvență â ¥ 5%)
| APIDRA,% (N = 950) |
Toți comparatoriiA, % (N = 641) |
|
| rinofaringita | 10.6 | 12.9 |
| hipoglicemiab | 6.8 | 6.7 |
| Infectia tractului respirator superior | 6.6 | 5.6 |
| gripă | 4.0 | 5.0 |
|
A Insulina lispro, insulina umană regulată, insulina aspart b Numai hipoglicemie severă simptomatică |
Tabelul 2: evenimente adverse de tratament la studii colectate la adulți cu diabet zaharat tip 2 (evenimente adverse cu frecvență - ‰ ¥ 5%)
| APIDRA,% (N = 883) |
Insulină umană regulată,% (N = 883) |
|
| Infectia tractului respirator superior | 10.5 | 7.7 |
| rinofaringita | 7.6 | 8.2 |
| Edem periferic | 7.5 | 7.8 |
| gripă | 6.2 | 4.2 |
| artralgia | 5.9 | 6.3 |
| Hipertensiune | 3.9 | 5. |
- Pediatrie
Tabelul 3 rezumă reacțiile adverse apărute cu o frecvență mai mare de 5% într-un studiu clinic la copii și adolescenți cu diabet de tip 1 tratat cu APIDRA (n = 277) sau insulină lispro (N = 295).
Tabelul 3: Tratament - evenimente adverse la tratament la copii și adolescenți cu diabet zaharat tip 1 (reacții adverse cu frecvență - 5%)
| APIDRA,% (N = 277) |
Lispro,% (N = 295) |
|
| rinofaringita | 9.0 | 9.5 |
| Infectia tractului respirator superior | 8.3 | 10.8 |
| Durere de cap | 6.9 | 11.2 |
| Crizele hipoglicemice | 6.1 | 4.7 |
- Hipoglicemie severă simptomatică
Hipoglicemia este reacția adversă cel mai frecvent observată la pacienții care utilizează insulină, inclusiv Apidra [Vezi Avertismente și precauții]. Ratele și incidența hipoglicemiei simptomatice severe, definită ca hipoglicemie care necesită intervenție de la o terță parte, au fost comparabile pentru toate regimurile de tratament (vezi Tabelul 4). În studiul clinic din faza 3, copiii și adolescenții cu diabet de tip 1 au avut o incidență mai mare de hipoglicemie severă simptomatică în cele două grupuri de tratament comparativ cu adulții cu tipul 1 Diabet. (vezi Tabelul 4) [Vezi Studii clinice].
Tabelul 4: Hipoglicemie severă simptomatică *
| Diabetul de tip 1 Adulți 12 săptămâni cu insulină glargină |
Diabetul zaharat de tip 1 Adulti 26 săptămâni cu insulină glargină |
Diabetul de tip 2 Adulți 26 săptămâni cu insulină umană NPH |
Diabet zaharat tip 1 26 săptămâni |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Apidra Pre-masa |
Apidra Post-masă |
Insulina umană regulată | Apidra | Insulina Lispro | Apidra | Insulina umană regulată | Apidra | Insulina Lispr | |
| * Hipoglicemie severă simptomatică definită ca un eveniment hipoglicemic care necesită asistența unei alte persoane care a îndeplinit unul dintre următoarele criterii: evenimentul a fost asociat cu o glicemie cu referire la sânge integral <36 mg / dL sau evenimentul a fost asociat cu recuperarea promptă după administrarea de carbohidrați orali, glucoză intravenoasă sau glucagon. | |||||||||
| Evenimente pe lună pe pacient | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Procentul pacienților (n / total N) | 8.4% (24/286) | 8.4% (25/296) | 10.1% (28/278) | 4.8% (16/339) |
4.0% (13/333) |
1.4% (6/416) |
1.2% (5/420) |
16.2% (45/277) |
19.3% (57/295) |
- Inițierea insulinei și intensificarea controlului glucozei
Intensificarea sau îmbunătățirea rapidă a controlului glucozei a fost asociată cu o trecere reversibilă tulburare de refracție oftalmologică, agravarea retinopatiei diabetice și periferică acută dureroasă neuropatie. Cu toate acestea, controlul glicemic pe termen lung scade riscul de retinopatie diabetică și neuropatie.
- Lipodistrofia
Utilizarea pe termen lung a insulinei, inclusiv Apidra, poate provoca lipodistrofie la locul injecțiilor sau infuziei repetate de insulină. Lipodistrofia include lipohipertrofia (îngroșarea țesutului adipos) și lipoatrofia (subțierea țesutului adipos) și poate afecta absorbția insulinei. Rotiți locurile de injecție sau perfuzie de insulină în aceeași regiune pentru a reduce riscul de lipodistrofie. [Vedea Dozaj si administrare].
- Creștere în greutate
Creșterea în greutate poate apărea cu ajutorul insulinoterapiei, inclusiv Apidra, și a fost atribuită efectelor anabolice ale insulinei și scăderii glucozuriei.
- Edemul periferic
Insulina, inclusiv Apidra, poate provoca retenție de sodiu și edem, mai ales dacă anterior controlul metabolic slab este îmbunătățit prin terapie cu insulină intensificată.
- Reacții adverse cu infuzie continuă de insulină subcutanată (CSII)
Într-un studiu randomizat de 12 săptămâni la pacienții cu diabet zaharat de tip 1 (n = 59), ratele cateterului ocluziile și reacțiile la locul perfuziei au fost similare pentru Apidra și insulin aspart (Tabelul 5).
Tabelul 5: Ocluziile cateterului și reacțiile locului infuziei.
| Apidra (N = 29) |
insulina aspart (N = 30) |
|
|---|---|---|
| Ocluzii de cateter / lună | 0.08 | 0.15 |
| Reacții la locul perfuziei | 10.3% (3/29) | 13.3% (4/30) |
- Reactii alergice
Alergie locală
Ca în orice terapie cu insulină, pacienții care iau Apidra pot prezenta roșeață, umflare sau mâncărime la locul injectării. Aceste reacții minore se rezolvă, de obicei, în câteva zile până la câteva săptămâni, dar în unele ocazii pot necesita întreruperea Apidra. În unele cazuri, aceste reacții pot fi legate de alți factori decât insulina, cum ar fi iritanții unui agent de curățare a pielii sau o tehnică de injecție slabă.
Alergie sistemică
Poate să apară o alergie severă, care poate pune viața în viață, generalizată, inclusiv anafilaxia, cu orice insulină, inclusiv Apidra. Alergia generalizată la insulină poate provoca erupții întregi ale corpului (inclusiv prurit), dispnee, respirație șuierătoare, hipotensiune, tahicardie sau diaforeză.
În studiile clinice controlate cu o durată de până la 12 luni, în 79 de reacții alergice sistemice potențiale au fost raportate 1833 pacienți (4,3%) care au primit Apidra și 58 din 1524 pacienți (3,8%) care au primit comparatorul cu acțiune scurtă insuline. În timpul acestor studii, tratamentul cu Apidra a fost întrerupt definitiv la 1 din 1833 de pacienți din cauza unei potențiale reacții alergice sistemice.
Reacțiile localizate și mialgiile generalizate au fost raportate cu utilizarea metacresolului, care este un excipient al Apidra.
Producția de anticorpi
Într-un studiu efectuat la pacienții cu diabet de tip 1 (n = 333), concentrațiile de anticorpi insulinici care reacționează atât cu insulina umană cât și cu insulina glulisina (anticorpi cu insulină reactivă încrucișată) a rămas aproape de valoarea inițială în primele 6 luni ale studiului la pacienții tratați cu Apidra. O scădere a concentrației de anticorpi a fost observată în următoarele 6 luni ale studiului. Într-un studiu la pacienții cu diabet zaharat de tip 2 (n = 411), o creștere similară a concentrației de anticorpi insulinici reactivă observate la pacienții tratați cu Apidra și la pacienții tratați cu insulină umană în primele 9 luni ale studiu. După aceea, concentrația de anticorpi a scăzut la pacienții cu Apidra și a rămas stabilă la pacienții cu insulină umană. Nu a existat nicio corelație între concentrația de anticorpi de insulină reactivă încrucișată și modificările HbA1c, dozele de insulină sau incidența hipoglicemiei. Nu este cunoscută semnificația clinică a acestor anticorpi.
Apidra nu a generat un răspuns semnificativ la anticorpi la un studiu la copii și adolescenți cu diabet zaharat de tip 1.
Experienta postmarketing
Următoarele reacții adverse au fost identificate în timpul utilizării Apidra după aprobare.
Deoarece aceste reacții sunt raportate voluntar de la o populație de dimensiuni incerte, nu este este întotdeauna posibilă estimarea fiabilă a frecvenței lor sau stabilirea unei relații de cauzalitate cu medicamentul expunere.
Au fost raportate erori de medicație în care alte insuline, în special insuline cu acțiune lungă, au fost administrate accidental în locul Apidra.
top
Interacțiunile medicamentoase
Câteva medicamente afectează metabolismul glucozei și pot necesita o ajustare a dozei de insulină și o monitorizare îndeaproape atentă.
Medicamentele care pot crește efectul de scădere a glucozei din sânge al insulinelor, inclusiv Apidra și, prin urmare, cresc riscul de hipoglicemie, includ produse antidiabetice orale, pramlintidă, inhibitori ACE, disopiramidă, fibrați, fluoxetină, inhibitori de monoaminoxidază, propoxifen, pentoxifilină, salicilați, analogi de somatostatină și sulfonamidă antibiotice.
Medicamentele care pot reduce efectul de reducere a glucozei din sânge al Apidra includ corticosteroizi, niacină, danazol, diuretice, agenți simpatomimetici (de exemplu, epinefrină, albuterol, terbutalină), glucagon, izoniazid, derivați de fenotiazină, somatropină, hormoni tiroidieni, estrogeni, progestogeni (de exemplu, în contraceptive orale), inhibitori de protează și atipici antipsihotice.
Beta-blocante, clonidină, săruri de litiu și alcool pot crește sau scade efectul de scădere a glucozei din sânge a insulinei.
Pentamidina poate provoca hipoglicemie, care poate fi uneori urmată de hiperglicemie.
Semnele hipoglicemiei pot fi reduse sau absente la pacienții care iau medicamente anti-adrenergice precum beta-blocante, clonidină, guanetidină și reserpină.
top
Utilizare în populații specifice
graviditate
Sarcina Categorie C: Studiile de reproducere și teratologie au fost efectuate cu insulina glulisină la șobolani și iepuri folosind insulină umană obișnuită ca comparator. Insulina glulisină a fost administrată la șobolani de-a lungul sarcinii, în doze subcutanate, până la 10 Unități / kg o dată pe zi (doza rezultând expunere de 2 ori mai mare decât doza medie umană, bazată pe comparația suprafeței corpului) și nu a avut efecte toxice remarcabile asupra embrionului dezvoltare.
Insulina glulisină a fost administrată iepurilor de sex feminin pe toată durata sarcinii, în doze subcutanate până la 1,5 Unități / kg / zi (doza care rezultă într-o expunere de 0,5 ori mai mare decât doza medie umană, pe baza suprafeței corpului comparaţie). Efectele adverse asupra dezvoltării embrio-fetale au fost observate doar la nivelurile de doză toxică maternă care induc hipoglicemie. A fost observată o incidență crescută a pierderilor post-implantare și a defectelor scheletului la o doză de 1,5 unități / kg o dată pe zi (doză rezultând o expunere de 0,5 ori mai mare decât doza medie umană, bazată pe comparația suprafeței corpului) care a provocat, de asemenea, mortalitate în baraje. O incidență ușoară crescută a pierderilor post-implantare a fost observată la următorul nivel de doză mai mic de 0,5 unități / kg o dată pe zi (doza rezultând într-o expunere 0,2 ori doza medie umană, bazată pe comparația suprafeței corporale), care a fost asociată și cu hipoglicemie severă, dar nu au existat defecte la doza. Nu s-au observat efecte la iepuri în doză de 0,25 unități / kg o dată pe zi (doza care rezultă într-o expunere de 0,1 ori mai mare decât doza medie umană, pe baza comparației suprafeței corporale). Efectele insulinei glulisinei nu au fost diferite de cele observate cu insulină umană regulată subcutanată în aceleași doze și au fost atribuite efectelor secundare ale hipoglicemiei materne.
Nu există studii clinice bine controlate privind utilizarea Apidra la femeile gravide. Deoarece studiile asupra reproducerii la animale nu sunt întotdeauna predictive pentru răspunsul uman, acest medicament trebuie utilizat în timpul sarcinii numai dacă beneficiul potențial justifică riscul potențial pentru făt. Este esențial pentru pacienții cu diabet zaharat sau cu antecedente de diabet gestațional să mențină un control metabolic bun înainte de concepție și de-a lungul sarcinii. Cerințele de insulină pot scădea în primul trimestru, cresc în general în al doilea și al treilea trimestru și pot scădea rapid după naștere. Monitorizarea atentă a controlului glucozei este esențială la acești pacienți.
Mame care alăptează
Nu se știe dacă insulina glulisină este excretată în laptele uman. Deoarece multe medicamente sunt excretate în laptele uman, trebuie luată prudență atunci când Apidra este administrată unei femei care alăptează. Utilizarea Apidra este compatibilă cu alăptarea, dar femeile cu diabet care alăptează pot necesita ajustări ale dozelor de insulină.
Utilizare pediatrică
Siguranța și eficacitatea injecțiilor subcutanate de Apidra au fost stabilite la pacienții pediatri (vârsta între 4 și 17 ani) cu diabet zaharat de tip 1 [Vezi Studii clinice]. Apidra nu a fost studiat la pacienți pediatri cu diabet zaharat tip 1 cu vârsta mai mică de 4 ani și la pacienții pediatri cu diabet zaharat tip 2.
Ca și la adulți, doza de Apidra trebuie individualizată la pacienții pediatri pe baza nevoilor metabolice și monitorizarea frecventă a glicemiei.
Utilizare geriatrică
În studiile clinice (n = 2408), Apidra a fost administrat la 147 de pacienți - 65 de ani și 27 de pacienți - 75 de ani. Majoritatea acestui mic subset de pacienți vârstnici aveau diabet de tip 2. Modificarea valorilor HbA1c și a frecvențelor hipoglicemiei nu a diferit în funcție de vârstă. Cu toate acestea, trebuie luată prudență atunci când Apidra este administrat la pacienți geriatri.
top
Supradozarea
Excesul de insulină poate provoca hipoglicemie și, în special atunci când este administrat intravenos, hipokalemie. Episoadele ușoare de hipoglicemie pot fi de obicei tratate cu glucoză orală. Poate fi necesară ajustarea dozelor de medicamente, a modelelor de masă sau a exercițiilor fizice. Episoadele mai severe de hipoglicemie cu comă, convulsii sau afectări neurologice pot fi tratate cu glucagon intramuscular / subcutanat sau glucoză intravenoasă concentrată. Pot fi necesare aportul și observarea menținute de carbohidrați, deoarece hipoglicemia poate reapărea după recuperarea clinică aparentă. Hipokalemia trebuie corectată în mod corespunzător.
Descriere
Apidra® (injecție cu insulină glulisină [origine rDNA]) este un analog cu insulină umană cu acțiune rapidă, utilizat pentru scăderea glicemiei. Insulina glulisină este produsă prin tehnologia ADN recombinantă care utilizează o tulpină de laborator non-patogenă de Escherichia coli (K12). Insulina glulisină diferă de insulina umană prin aceea că, asparagina aminoacidă în poziția B3 este înlocuită de lizină, iar lizina în poziția B29 este înlocuită de acid glutamic. Chimic, insulina glulisină este 3B-lizină-29B-acid glutamic-insulină umană, are formula empirică C258H384N64O78S6 și o greutate moleculară de 5823 și are următoarea formulă structurală:
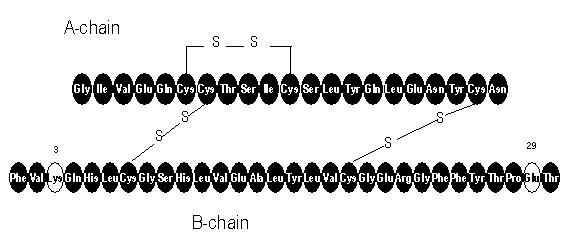
Apidra este o soluție sterilă, apoasă, limpede și incoloră. Fiecare mililitru de Apidra conține 100 de unități (3,49 mg) insulină glulisină, 3,15 mg metacresol, 6 mg trometamină, 5 mg clorură de sodiu, 0,01 mg polisorbat 20 și apă pentru injecție. Apidra are un pH de aproximativ 7,3. PH-ul este ajustat prin adăugarea de soluții apoase de acid clorhidric și / sau hidroxid de sodiu.
top
Farmacologie clinică
Mecanism de acțiune
Reglarea metabolismului glucozei este activitatea principală a insulinelor și analogilor de insulină, inclusiv a insulinei glulisinei. Insulinele scad glicemia prin stimularea absorbției periferice a glucozei prin mușchii și grăsimile scheletice și prin inhibarea producției de glucoză hepatică. Insulinele inhibă lipoliza și proteoliza și îmbunătățesc sinteza proteinelor.
Activitățile de scădere a glucozei din Apidra și a insulinei umane obișnuite sunt echipotente atunci când sunt administrate pe cale intravenoasă. După administrarea subcutanată, efectul Apidra este mai rapid la debut și cu o durată mai scurtă în comparație cu insulina umană obișnuită. [Vezi Farmacodinamica].
Farmacodinamica
Studiile efectuate la voluntari sănătoși și la pacienții cu diabet au demonstrat că Apidra are o evoluție mai rapidă debutul acțiunii și o durată de activitate mai scurtă decât insulina obișnuită atunci când este administrată subcutanat.
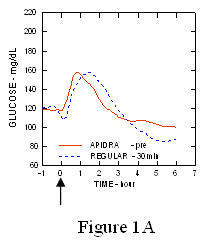
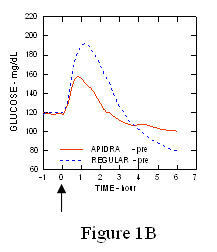
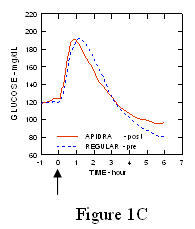
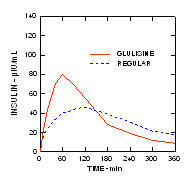
Într-un studiu efectuat la pacienții cu diabet zaharat de tip 1 (n = 20), s-au redus profilele de scădere a glucozei din Apidra și insulina umană obișnuită a fost evaluată în diferite momente în raport cu o masă standard la o doză de 0,15 Unități / kg. (Figura 1.)
Excursia maximă a glicemiei (Î ”GLUmax; Concentrația de glucoză scăzută inițial) pentru Apidra injectat cu 2 minute înainte de masă a fost 65 mg / dL comparativ cu 64 mg / dL pentru omul obișnuit insulină injectată cu 30 de minute înainte de masă (vezi Figura 1A) și 84 mg / dL pentru insulină umană obișnuită injectată cu 2 minute înainte de masă (vezi Figura 1B). Excursia maximă a glicemiei pentru Apidra injectată la 15 minute după începerea mesei a fost de 85 mg / dL comparativ cu 84 mg / dL pentru insulina umană obișnuită injectată cu 2 minute înainte de masă (vezi Figura 1C).
figura 1. Glicemia medie în serie a fost colectată până la 6 ore după o singură doză de Apidra și insulină umană regulată. Apidra a fost administrat cu 2 minute (Apidra - pre) înainte de începerea unei mese în comparație cu insulina umană obișnuită administrată 30 de minute (obișnuit - 30 min) înainte de începerea mesei (Figura 1A) și comparativ cu insulina umană obișnuită (Regular - pre) administrată cu 2 minute înainte de masă (fig. 1B). Apidra a fost administrat 15 minute (Apidra - post) după începerea unei mese în comparație cu insulina umană obișnuită (Regular - pre) administrată cu 2 minute înainte de masă (Figura 1C). Pe axa x zero (0) este începutul unei mese de 15 minute.
 |
 |
 |
 |
Într-un studiu aleatoriu, open-label, cu două căi crossover, 16 subiecți bărbați sănătoși au primit un tratament intravenos perfuzie de Apidra sau insulină umană obișnuită cu diluant salin, la o viteză de 0,8 milliUniti / kg / min pentru două ore. Infuzia cu aceeași doză de Apidra sau insulina umană obișnuită a produs eliminarea echivalentă a glucozei în stare constantă.
Farmacocinetica
Absorbție și biodisponibilitate
Profilele farmacocinetice la voluntarii sănătoși și pacienții cu diabet (tip 1 sau tip 2) au demonstrat că absorbția insulinei glulisinei a fost mai rapidă decât cea a insulinei umane obișnuite.
Într-un studiu la pacienții cu diabet de tip 1 (n = 20) după administrarea subcutanată de 0,15 unități / kg, timpul mediu până la concentrația maximă (Tmax) a fost de 60 minute (interval de 40 până la 120 minute) și concentrația de vârf (Cmax) a fost de 83 microUnități / mL (intervalul 40 până la 131 microUnități / ml) pentru insulina glulisină comparativ cu un Tmax median de 120 minute (interval de 60 până la 239 minute) și un Cmax de 50 microUnități / mL (interval între 35 și 71 microUnități / mL) pentru om obișnuit insulină. (Figura 2)
Figura 2. Profilele farmacocinetice ale insulinei glulisinei și insulinei umane obișnuite la pacienții cu diabet zaharat tip 1 după o doză de 0,15 unități / kg.
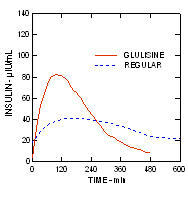
Insulina glulisină și insulina umană obișnuită au fost administrate subcutanat la o doză de 0,2 unități / kg în an studiu de clemă euglicemică la pacienții cu diabet de tip 2 (n = 24) și un indice de masă corporală (IMC) între 20 și 36 kg / m2. Timpul mediu până la concentrația maximă (Tmax) a fost de 100 minute (intervalul 40 până la 120 minute) și concentrația maximă mediană (Cmax) a fost de 84 microUnități / mL (intervalul 53 la 165 microUnități / mL) pentru insulina glulisină în comparație cu un Tmax median de 240 de minute (interval de 80 până la 360 minute) și un Cmax median de 41 microUnități / ml (interval 33-61 microUnități / mL) pentru insulina umană obișnuită. (Figura 3.)
Figura 3. Profilele farmacocinetice ale insulinei glulisinei și insulinei umane obișnuite la pacienții cu diabet zaharat tip 2 după o doză subcutanată de 0,2 unități / kg.
Când Apidra a fost injectat subcutanat în diferite zone ale corpului, profilurile de concentrare a timpului au fost similare. Biodisponibilitatea absolută a insulinei glulisinei după administrarea subcutanată este de aproximativ 70%, indiferent de zona de injecție (abdomen 73%, deltoid 71%, coapsă 68%).
Într-un studiu clinic efectuat la voluntari sănătoși (n = 32) biodisponibilitatea totală a insulinei glulisinei a fost similară după injecție de insulină glulisină și insulină NPH (preamestecată în seringă) și urmând separat subcutanat simultan preparate injectabile. A fost atenuată 27% din concentrația maximă (Cmax) de Apidra după preamestecare; cu toate acestea, timpul până la concentrare maximă (Tmax) nu a fost afectat. Nu sunt disponibile date privind amestecarea Apidra cu preparate de insulină, altele decât insulina NPH. [Vedea Studii clinice].
Distribuție și eliminare
Distribuția și eliminarea insulinei glulisinei și a insulinei umane obișnuite după administrarea intravenoasă administrarea este similară cu volumele de distribuție de 13 și 21 L și timpul de înjumătățire de 13 și 17 minute, respectiv. După administrarea subcutanată, insulina glulisină este eliminată mai rapid decât insulina umană obișnuită, cu un timp de înjumătățire aparent de 42 de minute comparativ cu 86 de minute.
Farmacologie clinică în populații specifice
Pacienți pediatri
Proprietățile farmacocinetice și farmacodinamice ale Apidra și insulinei umane obișnuite au fost evaluate în a studiu efectuat la copii între 7 și 11 ani (n = 10) și adolescenți 12-16 ani (n = 10) cu tipul 1 Diabet. Diferențele relative în farmacocinetică și farmacodinamică între Apidra și insulina umană obișnuită din acești pacienți cu diabet de tip 1 au fost similari cu cei la subiecții adulți sănătoși și adulții cu tipul 1 Diabet.
Cursă
Un studiu efectuat pe 24 de subiecți caucazieni sănătoși și japonezi a comparat farmacocinetica și farmacodinamica după injectarea subcutanată a insulinei glulisine, insulinei lispro și insulinei umane obișnuite. Odată cu injecția subcutanată de insulină glulisină, subiecții japonezi au avut o expunere inițială mai mare (33%) pentru raportul dintre ASC (0-1 ore) și ASC (capăt de 0 clemă) decât caucazieni (21%), deși expunerile totale au fost similare. Au fost descoperiri similare cu insulina lispro și insulina umană obișnuită.
obezitatea
Insulina glulisină și insulina umană obișnuită au fost administrate subcutanat în doză de 0,3 unități / kg în a studiu de clemă euglicemică la subiecți obezi, non-diabetici (n = 18) cu un indice de masă corporală (IMC) între 30 și 40 kg / m2. Timpul mediu până la concentrația maximă (Tmax) a fost de 85 minute (intervalul 49 până la 150 minute) și concentrația maximă mediană (Cmax) a fost de 192 microUnități / mL (intervalul 98 până la 380 microUnități / mL) pentru insulina glulisină în comparație cu un Tmax median de 150 minute (interval de 90 până la 240 minute) și un Cmax median de 86 microUnități / mL (între 43 și 175 microUnități / mL) pentru omul obișnuit insulină.
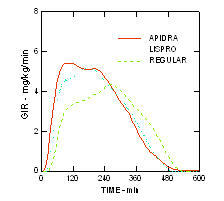
Debutul mai rapid al acțiunii și durata mai scurtă a activității Apidra și insulinei lispro în comparație cu insulina umană obișnuită au fost menținute la o populație obeză non-diabetică (n = 18). (Figura 4.)
Figura 4. Rata perfuziei de glucoză (GIR) într-un studiu de clemă euglicemică după injecția subcutanată de 0,3 unități / kg de Apidra, insulină lispro sau insulină umană obișnuită la o populație obeză.
Insuficiență renală
Studiile efectuate cu insulina umană au arătat creșterea nivelului circulator al insulinei la pacienții cu insuficiență renală. Într-un studiu efectuat la 24 de subiecți non-diabetici cu funcție renală normală (ClCr> 80 ml / min), insuficiență renală moderată (30-50 ml / min) și insuficiență renală severă (avertizări și precauții).
Insuficiență hepatică
Efectul insuficienței hepatice asupra farmacocineticii și farmacodinamicii Apidra nu a fost studiat. Unele studii cu insulină umană au arătat creșterea nivelului circulator al insulinei la pacienții cu insuficiență hepatică. [Vedea Avertismente și precauții].
Sex
Nu a fost studiat efectul genului asupra farmacocineticii și farmacodinamicii Apidra.
graviditate
Nu a fost studiat efectul sarcinii asupra farmacocineticii și farmacodinamicii Apidra.
Fumat
Efectul fumatului asupra farmacocineticii și farmacodinamicii Apidra nu a fost studiat.
top
Toxicologie nonclinică
Carcinogeneza, mutageneza, afectarea fertilității
Nu s-au efectuat studii standard de carcinogenitate de 2 ani la animale. La șobolanii Sprague Dawley, un studiu de toxicitate în doză repetată de 12 luni a fost realizat cu insulină glulisină în doze subcutanate de 2,5, 5, 20 sau 50 unități / kg de două ori pe zi (doza rezultând într-o expunere 1, 2, 8 și 20 de ori mai mare decât doza medie umană, pe baza suprafeței corpului comparaţie).
A existat o incidență non-dependentă a dozei de tumori ale glandei mamare la șobolani de sex feminin administrate insulină glulisină în comparație cu controalele netratate. Incidența tumorilor mamare pentru insulina glulisină și insulina umană obișnuită a fost similară. Nu este cunoscută relevanța acestor descoperiri pentru oameni. Insulina glulisină nu a fost mutagenă în următoarele teste: Test Ames, cromozom in vitro la mamifer test de aberație în celulele de hamster chinezesc V79 și test in micronucleu de eritrocit in mamifer in vivo șobolani.
În studiile de fertilitate la șobolan masculin și feminin, în doze subcutanate, până la 10 Unități / kg o dată pe zi (doza rezultând într-o expunere de 2 ori mai mare decât media umană doza, pe baza comparației suprafeței corporale), nu au avut efecte adverse clare asupra fertilității masculine și feminine sau a performanței generale de reproducere a animalelor observate.
top
Studii clinice
Siguranța și eficacitatea Apidra au fost studiate la pacienții adulți cu diabet zaharat tip 1 și 2 (n = 1833) și la copii și adolescenți (4 până la 17 ani) cu diabet zaharat tip 1 (n = 572). Parametrul de eficacitate primar în aceste studii a fost controlul glicemic, evaluat folosind hemoglobină glicată (GHb raportat ca echivalent HbA1c).
Diabet zaharat tip 1
Un studiu de 26 de săptămâni, randomizat, deschis, controlat activ, non-inferioritate, a fost realizat la pacienții cu diabet de tip 1 pentru a evalua siguranța și eficacitatea Apidra (n = 339) comparativ cu insulina lispro (n = 333) atunci când se administrează subcutanat în decurs de 15 minute înainte de masă. Insulina glargină a fost administrată o dată pe zi seara sub formă de insulină bazală. A existat o perioadă de 4 săptămâni cu insulină lispro și insulină glargină înainte de randomizare. Majoritatea pacienților erau caucazieni (97%). Cincizeci și opt la sută dintre pacienți erau bărbați. Vârsta medie a fost de 39 de ani (între 18 și 74 de ani). Controlul glicemic, numărul de injecții zilnice de insulină cu acțiune scurtă și dozele zilnice totale de Apidra și insulină lispro au fost similare în cele două grupuri de tratament (tabelul 6).
Tabelul 6: Diabetul zaharat tip 1 - adult
| Durata tratamentului Tratament în combinație cu: |
26 săptămâni Insulina glargină |
|
|---|---|---|
| Apidra | Insulina Lispro | |
| ||
| Hemoglobină glicată (GHb)* (%) | ||
| Numărul de pacienți | 331 | 322 |
| Media de bază | 7.6 | 7.6 |
| Modificare medie ajustată de la linia de bază | -0.1 | -0.1 |
| Diferența de tratament: Apidra - Insulina Lispro | 0.0 | |
| IC 95% pentru diferența de tratament | (-0.1; 0.1) | |
| Doza bazală de insulină (unități / zi) | ||
| Media de bază | 24 | 24 |
| Modificare medie ajustată de la linia de bază | 0 | 2 |
| Doza de insulină cu acțiune scurtă (unități / zi) | ||
| Media de bază | 30 | 31 |
| Modificare medie ajustată de la linia de bază | -1 | -1 |
| Numărul mediu de injecții cu insulină cu acțiune scurtă pe zi | 3 | 3 |
| Greutate corporală (kg) | ||
| Media de bază | 73.9 | 74.1 |
| Modificarea medie de la nivelul de bază | 0.6 | 0.3 |
Diabet zaharat tip 2
Un studiu de 26 de săptămâni, randomizat, deschis, controlat activ, non-inferioritate, a fost efectuat la pacienții tratați cu insulină cu diabet de tip 2 pentru a evalua siguranța și eficacitatea Apidra (n = 435) administrate în 15 minute înainte de masă, comparativ cu insulina umană obișnuită (n = 441) administrată cu 30 până la 45 minute înainte de masă. Insulina umană NPH a fost administrată de două ori pe zi sub formă de insulină bazală. Toți pacienții au participat la o perioadă de 4 săptămâni cu insulină umană obișnuită și insulină umană NPH. Optzeci și cinci la sută dintre pacienți erau caucazieni și 11% negri. Vârsta medie a fost de 58 de ani (între 26 și 84 de ani). Indicele mediu de masă corporală (IMC) a fost de 34,6 kg / m2. La randomizare, 58% dintre pacienți au luat un medicament antidiabetic oral. Acești pacienți au fost instruiți să continue utilizarea medicamentului antidiabetic oral în aceeași doză pe parcursul studiului. Majoritatea pacienților (79%) și-au amestecat insulina cu acțiune scurtă cu insulina umană NPH imediat înainte de injectare. Reducerile de la nivelul inițial al GHb au fost similare între cele 2 grupuri de tratament (a se vedea tabelul 7). Nu s-au observat diferențe între Apidra și grupele obișnuite de insulină umană în numărul de injecții zilnice de insulină cu acțiune scurtă sau doze de insulină cu acțiune bazală sau de scurtă durată. (Vezi tabelul 7.)
Tabelul 7: Diabet zaharat tip 2 Mellitus-adult
| Durata tratamentului | 26 săptămâni | |
|---|---|---|
| Tratament în combinație cu: | NPH insulină umană | |
| Apidra | Insulina umană regulată | |
| ||
| Hemoglobină glicată (GHb)* (%) | ||
| Numărul de pacienți | 404 | 403 |
| Media de bază | 7.6 | 7.5 |
| Modificare medie ajustată de la linia de bază | -0.5 | -0.3 |
| Diferența de tratament: Apidra - Insulină umană regulată | -0.2 | |
| IC 95% pentru diferența de tratament | (-0.3; -0.1) | |
| Doza bazală de insulină (unități / zi) | ||
| Media de bază | 59 | 57 |
| Modificare medie ajustată de la linia de bază | 6 | 6 |
| Doza de insulină cu acțiune scurtă (unități / zi) | ||
| Media de bază | 32 | 31 |
| Modificare medie ajustată de la linia de bază | 4 | 5 |
| Numărul mediu de injecții cu insulină cu acțiune scurtă pe zi | 2 | 2 |
| Greutate corporală (kg) | ||
| Media de bază | 100.5 | 99.2 |
| Modificarea medie de la nivelul de bază | 1.8 | 2.0 |
Diabet zaharat tip 1: Administrare înainte și după masă
Un studiu de 12 săptămâni, randomizat, deschis, controlat activ, non-inferioritate, a fost realizat la pacienții cu diabet de tip 1 pentru a evalua siguranța și eficacitatea Apidra administrate în momente diferite în raport cu a masă. Apidra a fost administrat subcutanat fie cu 15 minute înainte de masă (n = 286), fie imediat după masa (n = 296) și insulina umană regulată (n = 278) a fost administrată subcutanat cu 30 până la 45 minute înainte de masă. Insulina glargină a fost administrată o dată pe zi, la culcare, ca insulină bazală. A existat o perioadă de 4 săptămâni cu insulină umană obișnuită și insulină glargină urmată de randomizare. Majoritatea pacienților erau caucazieni (94%). Vârsta medie a fost de 40 de ani (între 18 și 73 de ani). Controlul glicemic (vezi Tabelul 8) a fost comparabil pentru cele 3 scheme de tratament. La numărul total zilnic de injecții de insulină cu acțiune scurtă nu au fost observate modificări de la nivelul inițial al tratamentelor. (Vezi tabelul 8.)
Tabelul 8: Administrarea înainte și după masă la diabetul zaharat de tip 1 Mellitus-adult
| Durata tratamentului Tratament în combinație cu: |
12 săptămâni insulină glargină |
12 săptămâni insulină glargină |
12 săptămâni insulină glargină |
|---|---|---|---|
| Apidra masa de dinainte |
Apidra după masă |
Insulina umană regulată | |
| |||
| Hemoglobină glicată (GHb)* (%) | |||
| Numărul de pacienți | 268 | 276 | 257 |
| Media de bază | 7.7 | 7.7 | 7.6 |
| Modificare medie ajustată de la linia de bază†| -0.3 | -0.1 | -0.1 |
| Doza bazală de insulină (unități / zi) | |||
| Media de bază | 29 | 29 | 28 |
| Modificare medie ajustată de la linia de bază | 1 | 0 | 1 |
| Doza de insulină cu acțiune scurtă (unități / zi) | |||
| Media de bază | 29 | 29 | 27 |
| Modificare medie ajustată de la linia de bază | -1 | -1 | 2 |
| Numărul mediu de injecții cu insulină cu acțiune scurtă pe zi | 3 | 3 | 3 |
| Greutate corporală (kg) | |||
| Media de bază | 79.2 | 80.3 | 78.9 |
| Modificarea medie de la nivelul de bază | 0.3 | -0.3 | 0.3 |
Diabetul zaharat de tip 1 Pacientii pediatrici
Un studiu de 26 de săptămâni, randomizat, deschis, controlat activ, non-inferioritate, a fost realizat la copii și adolescenți mai mari de 4 ani cu tipul 1 diabet zaharat pentru a evalua siguranța și eficacitatea Apidra (n = 277) în comparație cu insulina lispro (n = 295) atunci când este administrat subcutanat în decurs de 15 minute înainte o masă. De asemenea, pacienții au primit insulină glargină (administrată o dată pe zi seara) sau insulină NPH (administrată o dată dimineața și o dată seara). A existat o perioadă de patru săptămâni cu insulină lispro și insulină glargină sau NPH înainte de randomizare. Majoritatea pacienților erau caucazieni (91%). Cincizeci la sută dintre pacienți erau bărbați. Vârsta medie a fost de 12,5 ani (între 4 și 17 ani). IMC mediu a fost de 20,6 kg / m2. Controlul glicemic (vezi tabelul 9) a fost comparabil pentru cele două scheme de tratament.
Tabelul 9: Rezultate ale unui studiu de 26 de săptămâni la pacienții pediatri cu diabet zaharat tip 1
| Apidra | lispro | |
|---|---|---|
| Numărul de pacienți | 271 | 291 |
| Insulina bazală | NPH sau insulină glargină | NPH sau insulină glargină |
| ||
| Hemoglobină glicată (GHb)* (%) | ||
| Media de bază | 8.2 | 8.2 |
| Modificare medie ajustată de la linia de bază | 0.1 | 0.2 |
| Diferența de tratament: medie (interval de încredere de 95%) | -0.1 (-0.2, 0.1) | |
| Doza bazală de insulină (unități / kg / zi) | ||
| Media de bază | 0.5 | 0.5 |
| Modificarea medie de la nivelul de bază | 0.0 | 0.0 |
| Doza de insulină cu acțiune scurtă (unități / kg / zi) | ||
| Media de bază | 0.5 | 0.5 |
| Modificarea medie de la nivelul de bază | 0.0 | 0.0 |
| Numărul mediu de injecții cu insulină cu acțiune scurtă pe zi | 3 | 3 |
| Greutatea medie de bază (kg) | 51.5 | 50.8 |
| Modificarea greutății medii de la valoarea inițială (kg) | 2.2 | 2.2 |
Diabet zaharat tip 1: perfuzie continuă de insulină subcutanată
Un studiu de control activ, randomizat, de 12 săptămâni (Apidra versus insulina aspart), realizat la adulți cu diabet de tip 1 (Apidra n = 29, insulina aspart n = 30) a evaluat utilizarea Apidra într-o insulină externă continuă subcutanată pompa. Toți pacienții erau caucazieni. Vârsta medie a fost de 46 de ani (între 21 și 73 de ani). Media GHB a crescut de la valoarea inițială la punct final în ambele grupuri de tratament (de la 6,8% la 7,0% pentru Apidra; de la 7,1% la 7,2% pentru insulina aspart).
top
Mod de furnizare / depozitare și manipulare
Cât este furnizat
| |
| Apidra 100 de unități pe ml (U-100) este disponibil ca: | |
| Flacoane de 10 ml | NDC 0088-2500-33 |
| Sistem de cartuș 3 ml*, pachet de 5 | NDC 0088-2500-52 |
| 3 ml stilou prefabricat SoloStar, pachet de 5 | NDC 0088-2502-05 |
Ace de stilou nu sunt incluse în ambalaje.
Ace de stilou BD Ultra-Fine ™ pentru a fi utilizate împreună cu OptiClik sunt vândute separat și sunt fabricate de Becton Dickinson și Company.
Solostar este compatibil cu toate ace de stilou de la Becton Dickinson and Company, Ypsomed și Owen Mumford.
Depozitare
Nu folosiți după data de expirare (vezi cutie și recipient).
Fiolă deschisă / Sistem de cartuș / SoloStar
Flacoanele Apidra, deschise, sistemele de cartușe și SoloStar nu trebuie să fie depozitate la frigider, la 36 ° F-46 ° F (2 ° C-8 ° C). Protejați-vă de lumină. Apidra nu trebuie păstrat în congelator și nu trebuie înghețat. Aruncați dacă a fost înghețat.
Flacoanele nedeschise / sistemele de cartuș / SoloStar care nu sunt păstrate la frigider trebuie utilizate în termen de 28 de zile.
Flacon deschis (în uz):
Flacoanele deschise, refrigerate sau nu, trebuie utilizate în termen de 28 de zile. Dacă refrigerarea nu este posibilă, flaconul deschis în utilizare poate fi păstrat nerefrigerat timp de până la 28 de zile distanță de căldură și lumină directă, atât timp cât temperatura nu este mai mare de 77 ° F (25 ° C).
Deschideți (în utilizare) cartuș:
Sistemul de cartuș deschis (în uz) introdus în OptiClik® NU trebuie refrigerat, ci trebuie menținut sub 25 ° C (77 ° F) departe de căldură și lumină directă. Sistemul de cartuș deschis (în uz) trebuie aruncat după 28 de zile. Nu depozitați OptiClik®, cu sau fără sistem de cartuș, într-un frigider.
Deschide (în utilizare) stilou preumplut SoloStar:
SoloStar-ul deschis (în uz) NU trebuie refrigerat, ci trebuie să fie sub 25 ° C (77 ° F) departe de căldură și lumină directă. SoloStar-ul deschis (în uz) păstrat la temperatura camerei trebuie aruncat după 28 de zile.
Seturi de perfuzie:
Seturile de infuzie (rezervoare, tuburi și catetere) și Apidra din rezervor trebuie aruncate după 48 de ore de utilizare sau după expunerea la temperaturi care depășesc 98,6 ° F (37 ° C).
Utilizare intravenoasă:
Saci de perfuzie pregătiți conform indicațiilor de mai jos DOZAJ SI ADMINISTRARE sunt stabile la temperatura camerei timp de 48 de ore.
Pregătirea și manipularea
După diluare pentru utilizare intravenoasă, soluția trebuie inspectată vizual pentru a detecta particule și decolorare înainte de administrare. Nu folosiți soluția dacă a devenit tulbure sau conține particule; folosiți numai dacă este clar și incolor. Apidra nu este compatibilă cu soluția Dextrose și soluția Ringers și, prin urmare, nu poate fi utilizată cu aceste lichide de soluție. Utilizarea Apidra cu alte soluții nu a fost studiată și, prin urmare, nu este recomandată.
Sistem de cartuș: Dacă OptiClik® (dispozitivul de livrare insulină pentru Apidra) funcționează defectuos, Apidra poate fi extras din sistemul de cartuș într-o seringă U-100 și injectat.
Apidra, insulina glusină, informații despre pacient (în engleză simplă)
Ultima actualizare: 02/2009
Informații detaliate despre semne, simptome, cauze, tratamente ale diabetului
Informațiile din această monografie nu sunt destinate să acopere toate utilizările posibile, indicații, precauții, interacțiuni medicamentoase sau efecte adverse. Aceste informații sunt generalizate și nu sunt destinate unor sfaturi medicale specifice. Dacă aveți întrebări despre medicamentele pe care le luați sau doriți mai multe informații, consultați medicul, farmacistul sau asistenta medicală.
înapoi la: Căutați toate medicamentele pentru diabet


